黑曲霉脂肪酶tabI酶学性质及乳酸乙酯合成能力的研究
酯类物质是中国白酒最主要的风味物质,其含量占风味物质总量的40%~65%,其中己酸乙酯、乙酸乙酯、乳酸乙酯、丁酸乙酯占总酯含量的90%以上,被称为形成白酒主要风味的四大酯[1]。与其他大多数酯类不同,乳酸乙酯结构中的羟基使其既能溶于乙醇又具有较好的亲水特性,在白酒中起到增加醇厚感、协调香味和压水味的作用[2]。在白酒十二大香型中,乳酸乙酯是米香型、豉香型、老白干香型白酒中最重要的酯类物质。郑岩[3]以桂林三花为对象研究了米香型白酒的指纹图谱,结果表明其组成成分简单,所含组分91%以上相似,相对峰面积最大的是异丙醇,其次是乳酸乙酯。杨帅等[4]对清雅型“玉冰烧”白酒酒体风格特征进行了剖析,结果表明清雅型“玉冰烧”白酒整体酯类比较单一,以乙酸乙酯和乳酸乙酯为主,且乳酸乙酯和乙酸乙酯的比值(1.3)独特。霍丽娜等[5]运用气相色谱技术分析了老白干原酒的微量成分,结果表明老白干酒的主要酯类物质是乳酸乙酯和乙酸乙酯,且原酒中的乳酸乙酯含量高于乙酸乙酯,乳酸乙酯在总酯中所占比例比其他香型都要高。
在白酒生产过程中,酯类物质的合成主要包括微生物代谢生成、有机化学反应生成和生物酶催化合成3种途径[6]。王月梅等[7]研究表明清香型酒中乙酸乙酯主要是由大量的生命活动旺盛的生香酵母及产酯霉菌等微生物的代谢生成。张浩等[8]研究表明,在浓香型大曲中己酸乙酯的合成主要以酯化酶催化作用为主,而丁酸乙酯和乳酸乙酯的合成以化学作用为主。吕云怀等[9]对酱香大曲、浓香大曲和清香大曲中的风味物质与其产品风格特征的关系进行了分析,结果表明其只在清香型大曲中检测到了乳酸乙酯。在以往酯类物质合成的研究中,多是围绕己酸乙酯和乙酸乙酯进行的,刘雪等[10]将华根霉麸曲作为粗酶制剂,催化己酸与乙醇发生酯化反应,使酒体中己酸乙酯的含量达2 302 mg/100mL;潘志友等[11]通过将南极假丝酵母脂肪酶B展示于酿酒酵母细胞表面,并将该重组酿酒酵母菌体冻干粉作为全细胞催化剂在非水相中催化合成了己酸乙酯,使其产率达98%;葛清秀等[12]研究了碱性脂肪酶在正庚烷中催化合成乙酸乙酯,转化率可达71.4%。
如前所述,老白干香型白酒中乳酸乙酯的含量相对较高,因此本研究拟从老白干香型大曲中分离酯化酶活力较高的黑曲霉菌株,并进行转录组分析,从黑曲霉菌株中克隆基因转录水平较高的脂肪酶基因tabI。然后使其在大肠杆菌BL21(DE3)中异源表达,并进行酶学性质和合成乳酸乙酯能力的解析,为乳酸乙酯脂肪酶的开发和应用奠定基础。
1 材料与方法
1.1 菌种
黑曲霉(Aspergillus niger)、大肠杆菌(Escherichia coli)DH5α和BL21(DE3)及质粒pET28a(+),均为本实验室保藏。
1.2 主要试剂
限制性内切酶、LA Taq DNA聚合酶,大连宝生物工程有限公司;同源重组酶,南京诺唯赞生物科技股份有限公司;质粒小量提取试剂盒、小量DNA产物纯化回收试剂盒、异丙基-β-D-硫代半乳糖苷(isopropyl-β-d-thiogalactoside,IPTG)、卡那霉素、BCA蛋白浓度测定试剂盒,北京索莱宝科技有限公司;Ni柱、PD-10脱盐柱,GE公司;C2~C16系列对硝基苯酚羧酸酯、其他生化试剂,均为分析纯,天津市江天化工技术有限公司。
1.3 酯化酶活力的测定
对从老白干香型大曲中分离出来的菌株,进行酯化酶活力的测定,具体方法参考文献[13]。
1.4 黑曲霉脂肪酶基因的克隆与表达
1.4.1 基因克隆与重组菌株的构建
将从老白干香型大曲中分离出的高酶活力菌株送至北京诺禾致源科技有限公司做转录组分析,筛选出基因注释为脂肪酶且基因转录水平较高的基因。在NCBI上与A.niger CBS 513.88相对比,获得基因转录水平较高基因的开放式阅读框(open reading frames,ORF),并送至金唯智生物科技有限公司进行基因合成及密码子优化。将合成后的片段利用PCR技术从载体pUC57上扩增下来并连接至质粒pET28a(+),将重组质粒转化至E.coliDH5α稳定后,再转化至E.coliBL21(DE3)进行诱导表达。
1.4.2 脂肪酶tabI的制备
将验证成功的重组菌株加入IPTG在20 ℃下诱导20 h后,离心收集菌体,并用pH 7.4的PBS缓冲液重悬菌体。菌体经过超声破碎后,离心获得含His-tag的融合蛋白上清液。含His-tag的融合蛋白经过Ni柱进行洗脱,洗脱下来的重组蛋白用PD-10脱盐柱进行脱盐,冷冻干燥备用。蛋白质浓度采用BCA蛋白浓度测定试剂盒进行测定。
1.5 脂肪酶tabI酶活力的测定与底物特异性分析
脂肪酶酶活力的测定方法参照文献方法[14-15],并做改进。500 μL的反应体系:400 μL、20 mmol/L、pH 7.4的PBS缓冲液、50 μL、5 mmol/L的pNPA和50 μL酶液。30 ℃下反应1 min后,在410 nm下测定吸光度值。脂肪酶活力定义为在一定pH和温度下,1 min催化对硝基苯酚羧酸酯水解生成1 μmol对硝基苯酚的酶量为1个酶活力单位[15-17]。
按照上述方法,分别以7种不同碳链长度(C2~C16)的对硝基苯酚羧酸酯为底物,测定脂肪酶tabI酶活力,以最高酶活力为100%计算相对酶活力[15]。
1.6 脂肪酶tabI动力学参数的测定
脂肪酶动力学参数根据Lineweaver-Burk双倒数作图法测定。以对硝基苯酚羧酸酯为底物,用无水乙醇配制一系列不同浓度的底物,按照1.5的方法测定不同底物浓度下的脂肪酶tabI酶活力。以底物浓度的倒数1/[S]为横坐标,反应速率的倒数1/[V]为纵坐标作图,并根据公式(1)计算得出Km和Vmax[16-19]。
(1)
1.7 脂肪酶tabI酶学特性分析
按照1.5的方法,对脂肪酶tabI进行酶学特性分析,以最高酶活力为100%计算相对酶活力。
(1)温度对脂肪酶tabI酶活力的影响:测定20~75 ℃ 的酶活力,每隔5 ℃为检测点。
(2)pH对脂肪酶tabI酶活力的影响:测定pH 4.5~10的酶活力,pH 4.5~5.5时缓冲液为20 mmol/L乙酸铵缓冲溶液,pH 6.0~7.5时缓冲液为20 mmol/L磷酸盐缓冲溶液,pH 8.0~9.0时缓冲液为20 mmol/L Tris-HCl缓冲溶液,pH 9.5、10.0时缓冲液为20 mmol/L甘氨酸-氢氧化钠缓冲溶液[15-17]。
(3)温度稳定性:将酶液分别在20、30、40、50、60 ℃ 放置0~4 h后,在最适作用条件下测定残余酶活力。
(4)pH稳定性:将酶液分别在pH为6、7、8、9、10环境下放置0~4 h后,在最适作用条件下测定残余酶活力。
(5)金属离子或螯合剂对脂肪酶tabI酶活力的影响:将40 μL酶液与不同的10 μL、1 mmol/L的金属离子或螯合剂混合,室温下放置2 h后,在最适作用条件下测定残余酶活力[16-17]。
(6)有机溶剂对脂肪酶tabI酶活力的影响:将40 μL的酶液与10 μL不同的有机溶剂混合,室温下、150 r/min 振荡2 h后,在最适作用条件下测定残余酶活力[16-17]。
1.8 脂肪酶tabI合成乳酸乙酯条件优化
参照文献[14,20],以叔丁醇为溶剂,配制不同浓度的乙醇和乳酸溶液,加入一定量的脂肪酶tabI,在40 ℃、150 r/min下反应12 h,用气相色谱法测定乳酸乙酯的含量,对照组加入相同量的高温灭活酶粉。
气相色谱检测条件为:检测器为FID,色谱柱为HP-INNOWAX(30 m×0.320 mm×0.25 μm),高纯度氮气载气流速设置为0.8 mL/min,进样口温度200 ℃,检测器温度210 ℃,进样量为1 μL,分流比为10∶1。起始色谱柱温度为50 ℃并维持8 min,然后按照5 ℃/min的速度提升到180 ℃,维持10 min[21-22]。
按照上述方法,优化脂肪酶tabI合成乳酸乙酯的反应条件。结果以实验组减去对照组的合成量表示。
(1)最佳乙醇浓度的确定:在反应体系中,乳酸浓度保持在1.17 mol/L,乙醇浓度分别为8.190、8.775、9.360、9.945、10.530、11.115 mol/L,测定乳酸乙酯合成量。
(2)最佳乳酸浓度的确定:在反应体系中,乙醇浓度按照上述实验获得的最佳乙醇浓度保持恒定,乳酸浓度分别为0.936、1.170、1.775、2.106、2.340、2.925 mol/L,测定乳酸乙酯合成量。
(3)最佳反应时间的确定:在反应体系中,乙醇和乳酸浓度按照上述实验获得的最佳浓度保持恒定,分别在反应时间为2~14 h时取样检测乳酸乙酯的合成量,每隔2 h为1个检测点,测定乳酸乙酯的合成量。
2 结果与分析
2.1 酯化酶活力测定
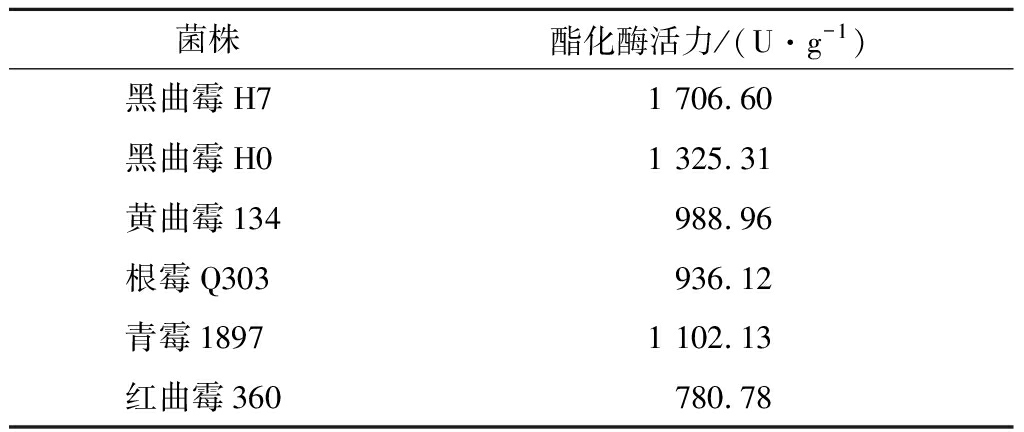
对从老白干大曲中分离出的菌株,进行了酯化酶活力的测定,结果见表1,在黑曲霉、黄曲霉、根霉、青霉、红曲霉中,黑曲霉H7的酯化酶活力是最高的,为1 706.60 U/g,所以选取黑曲霉菌株H7送至诺禾致源公司做转录组分析。
表1 菌株酯化酶活力的测定结果
Table 1 The results of the determination of the strain′s esterification enzyme activity
2.2 基因克隆与蛋白的表达
通过转录组分析获得了9个基因转录水平较高的脂肪酶基因,按照1.4.1的方法进行重组质粒的构建,成功构建出了重组质粒,并将这些重组质粒在大肠杆菌BL21(DE3)中异源表达,其中只有一个是可溶性表达,其余8个均为包涵体,将可溶性表达的脂肪酶基因与A.niger CBS 513.88相对比,该基因在基因组CBS 513.88中基因序号为An12g04640,命名为tabI。重组质粒Pet28a(+)-tabI构建流程如图1所示,经过质粒酶切验证带条大小与目的片段一致,如图2所示。
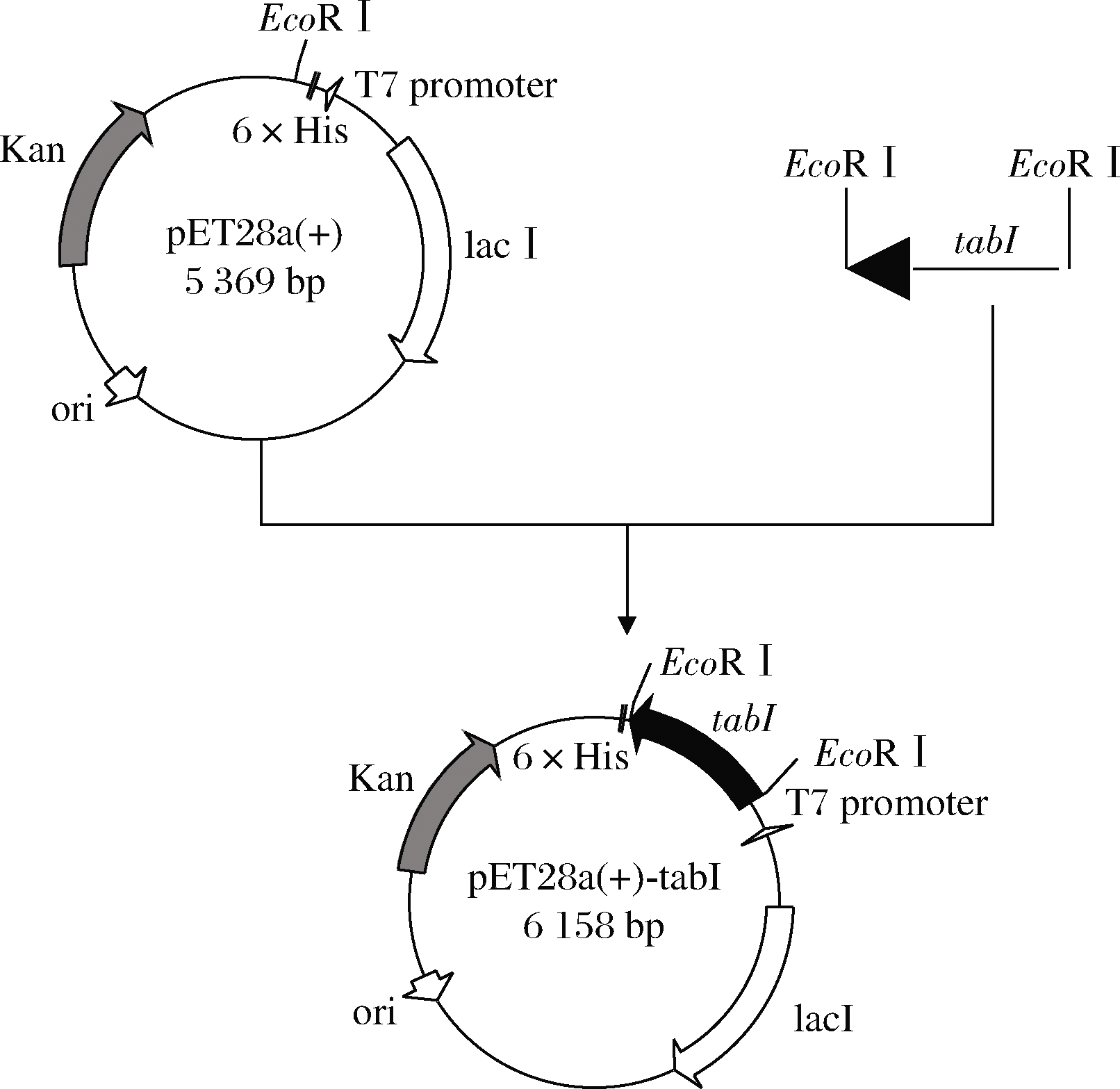
图1 重组载体pET28a(+)-tabI构建流程图
Fig.1 The construction flow chart of the recombinant vector pET28a(+)-tabI
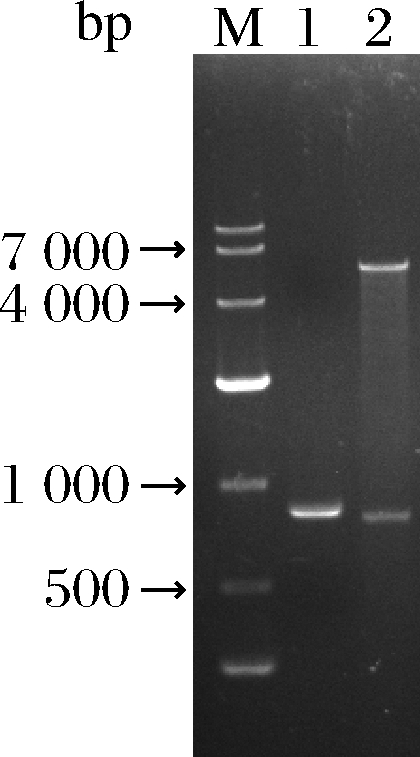
M-100 00 marker.1-带同源臂目的基因825 bp; 2-重组质粒EcoR Ι单酶切验证(从上至下条带大小分别为 5 375 bp和783 bp)
图2 目的基因和重组质粒验证图谱
Fig.2 The target gene and recombinant plasmid verification map
2.3 脂肪酶tabI的制备
重组菌株BL21-tabI经过IPTG诱导表达后的上清液用不同浓度的咪唑洗脱,洗脱液进行SDS-PAGE,结果如图3所示。在100 mmol/L浓度的咪唑处,出现较浓的单一条带。脂肪酶tabI的分子质量约为29 kDa,与预测的蛋白分子质量一致。图中重组蛋白tabI破碎后的沉淀中出现了3条较浓条带,其中上面2条为空质粒pET28a(+)的蛋白条带,第3条蛋白条带有两部分来源,一是空质粒pET28a(+)的蛋白条带,二是沉淀中没有溶解部分脂肪酶tabI的蛋白条带。
因此,后续脂肪酶tabI均可以用100 mmol/L浓度的咪唑洗脱,洗脱液用PD-10脱盐柱进行脱盐后,冷冻干燥备用。脱盐后的脂肪酶tabI比酶活力为54.34 U/mg。
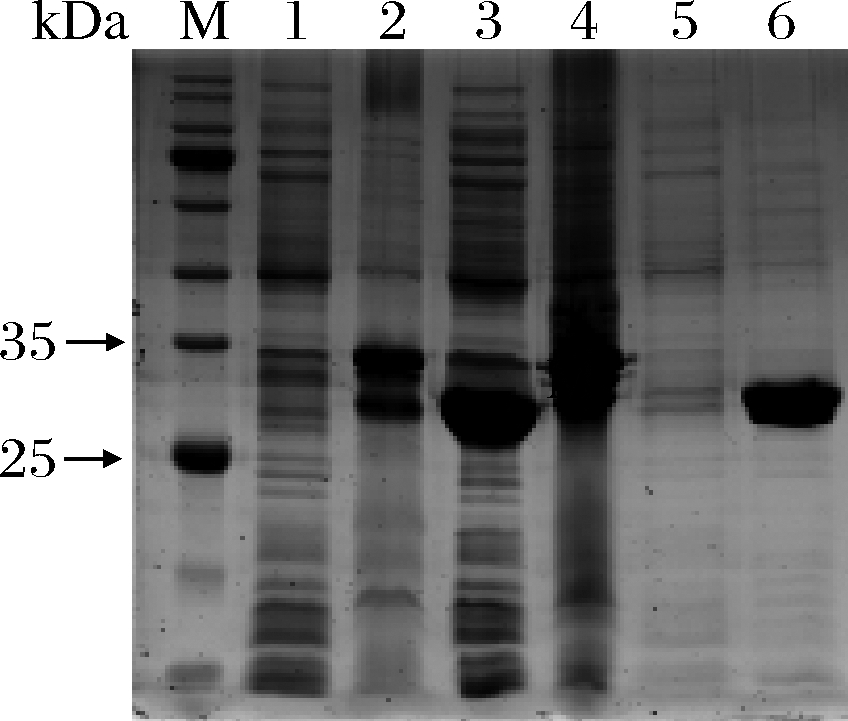
M-蛋白分子质量标准;1-空pET28a(+)破碎后的上清液; 2-空pET28a(+)破碎后的沉淀;3-重组蛋白tabI破碎后的上清液; 4-重组蛋白tabI破碎后的沉淀;5-用10 mmol/L咪唑洗脱的 重组蛋白tabI;6-用100 mmol/L咪唑洗脱的重组蛋白tabI
图3 脂肪酶tabI的SDS-PAGE图谱
Fig.3 The SDS-PAGE electrophoresis pattern of lipase tabI
2.4 脂肪酶tabI 底物特异性分析及动力学参数测定
按照1.5的方法,进行脂肪酶tabI底物特异性分析,结果如图4所示,脂肪酶tabI偏好于水解短链对硝基苯酚羧酸酯,对中长链对硝基苯酚羧酸酯基本没有水解作用,其最适作用底物为对硝基苯酚乙酸酯。
按照1.6的方法,以不同浓度的对硝基苯酚乙酸酯为底物,在40 ℃、pH 8下测定脂肪酶酶活力,采用双倒数作图法,绘制脂肪酶tabI的酶动力学曲线,可得脂肪酶tabI的Km值为0.85 mmol/L,Vmax值为63.75 mmol/(mL·h)。
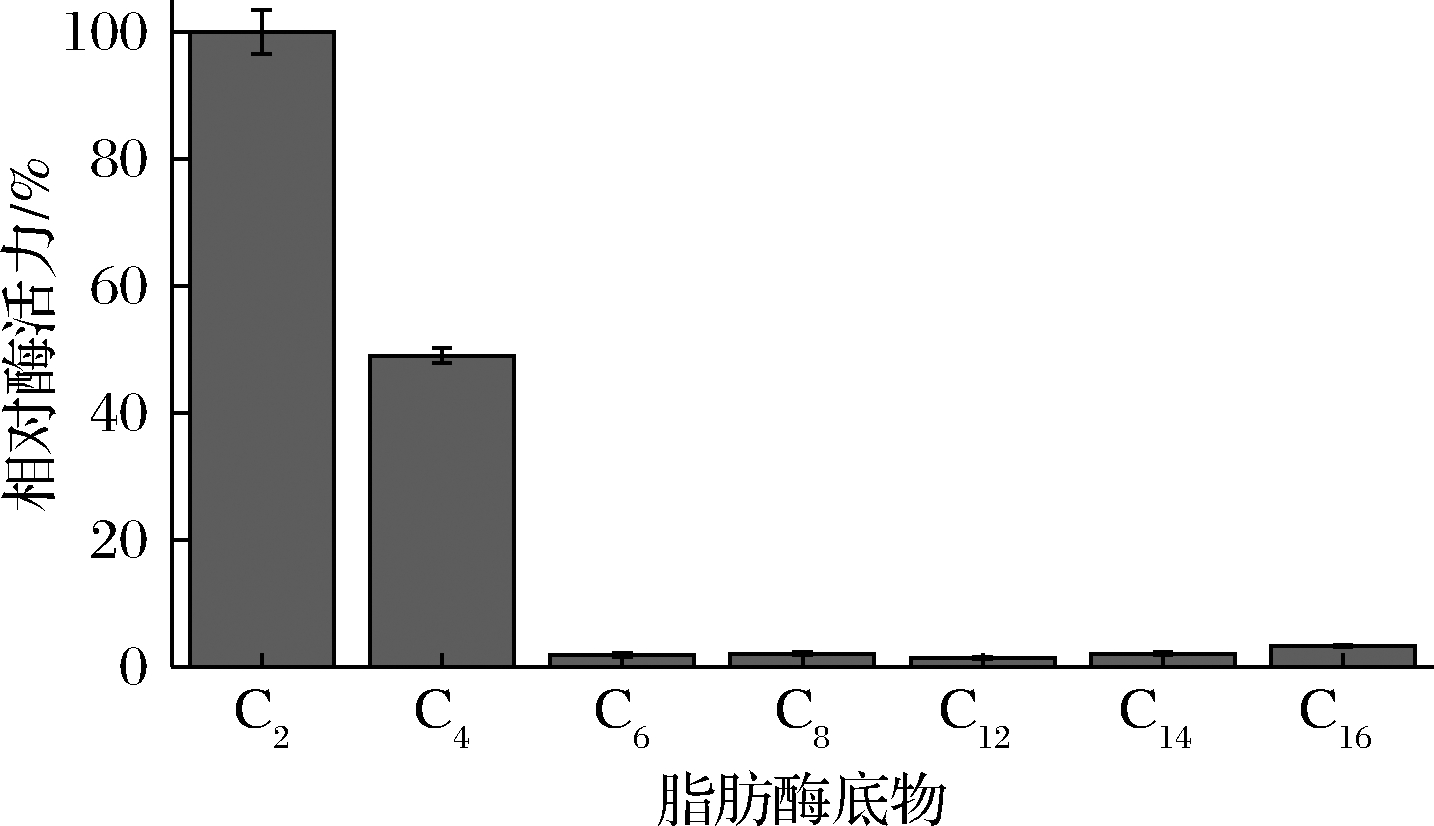
图4 脂肪酶tabI的底物特异性
Fig.4 The substrate specificity of lipase tabI
2.5 脂肪酶tabI酶学特性分析
2.5.1 脂肪酶tabI最适温度和最适pH
按照1.7的方法,测定脂肪酶tabI的最适作用温度和最适作用pH,结果如图5所示。由图5-a可知,脂肪酶tabI的酶活力随着温度的升高呈现先升高再降低的趋势。在40 ℃时,脂肪酶tabI的酶活力最高,表明脂肪酶tabI的最适作用温度为40 ℃,且在40~55 ℃,脂肪酶tabI的酶活力均保持在60%以上。由图5-b可知,脂肪酶tabI的酶活力随着pH的升高而升高,在pH=8时脂肪酶tabI的酶活力最高,之后脂肪酶tabI的酶活力随着pH的升高而降低,在pH为7~9时tabI的酶活力保持在60%以上。
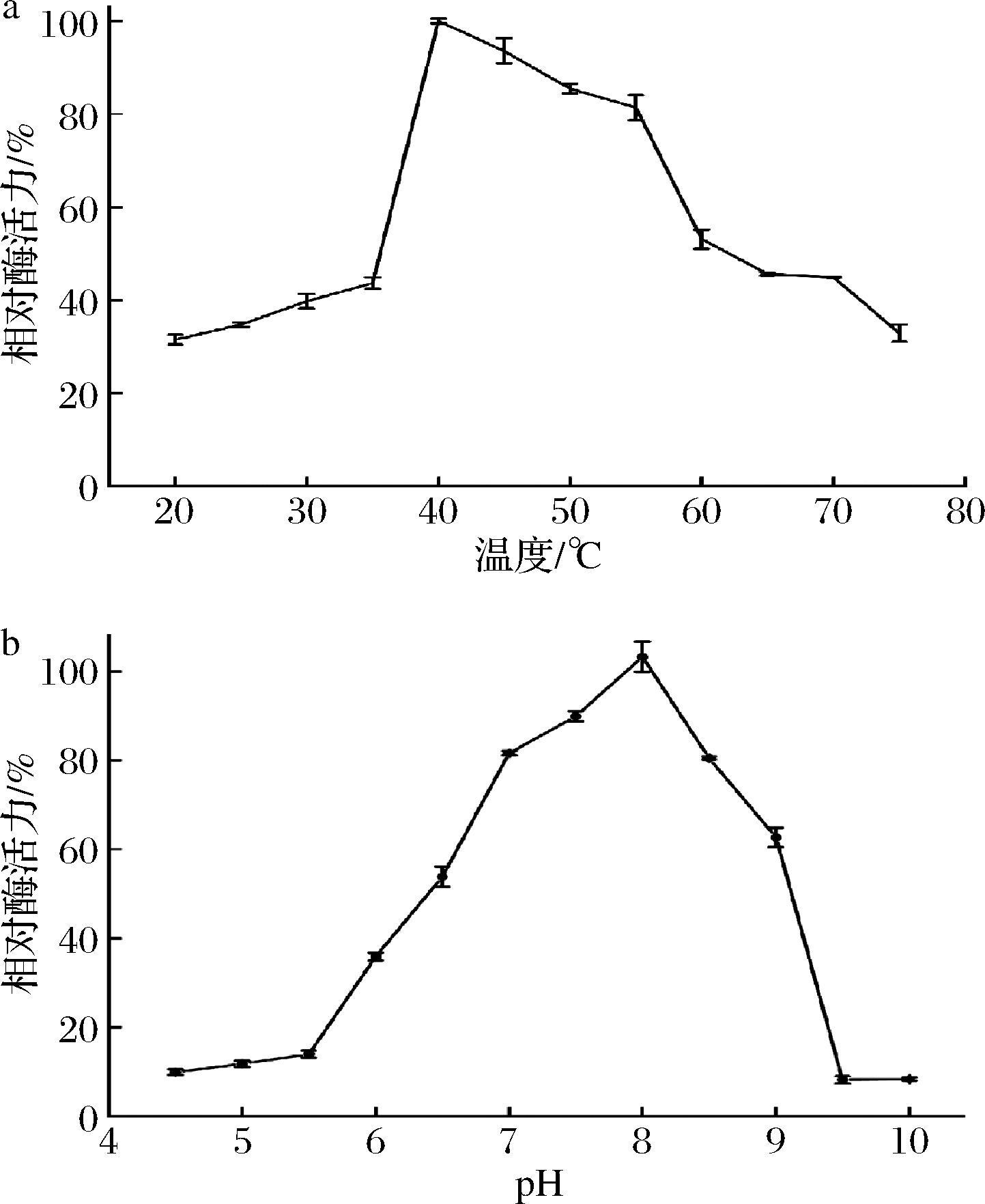
a-最适温度;b-最适pH
图5 脂肪酶tabI的最适温度和最适pH
Fig.5 The optimum temperature and optimum pH of lipase tabI
2.5.2 脂肪酶tabI的热稳定性和pH稳定性
按照1.7的方法,测定脂肪酶tabI的热稳定性和pH稳定性,结果如图6所示。由图6-a可知,在30 ℃和40 ℃时,脂肪酶tabI最稳定,在4 h内残余酶活力均在80%以上,随着温度的升高,酶活力下降速率明显上升,在20 ℃时,脂肪酶tabI在3 h内的残余酶活力保持在80%以上,在50 ℃和60 ℃时,脂肪酶tabI在3 h内的残余酶活力保持在60%以上。由图6-b可知,在pH 7、8、9时,脂肪酶tabI最稳定,在4 h内的残余酶活力均在80%以上。在pH 6和pH 10时,脂肪酶tabI的稳定性下降。
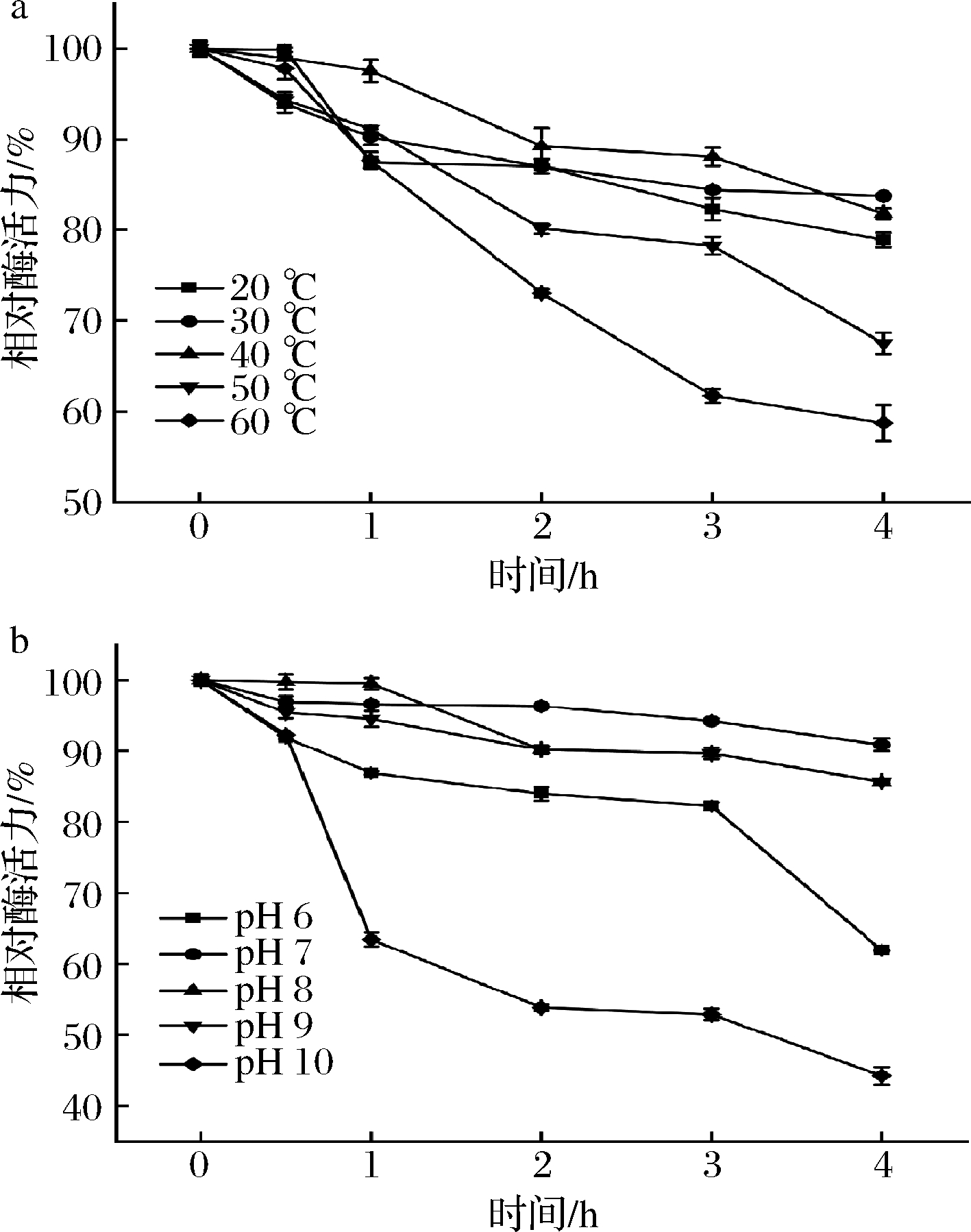
a-热稳定性;b-pH稳定性
图6 脂肪酶tabI的热稳定性和pH稳定性
Fig.6 The thermal stability and pH stability of the lipase tabI
2.5.3 金属离子及螯合剂对脂肪酶tabI活力的影响
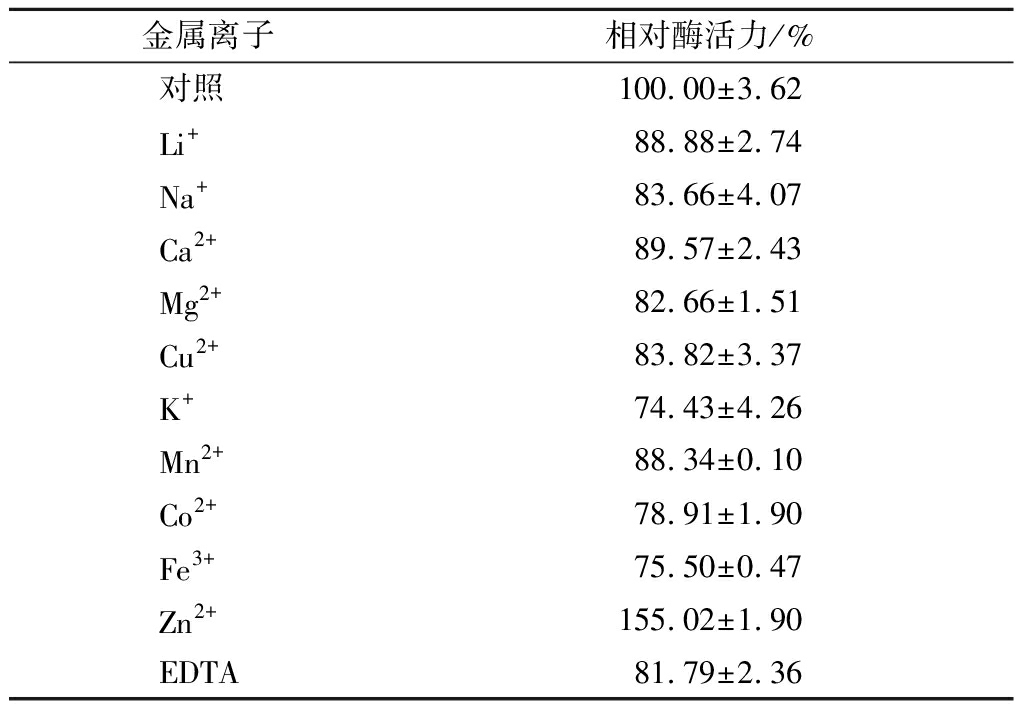
表2为金属离子及螯合剂对脂肪酶酶活力的影响,Zn2+对脂肪酶tabI的酶活力有明显的促进作用,酶活力提高了55.02%;其他金属离子和螯合剂EDTA 都对酶活力表现为抑制作用,其中K+、Co2+和Fe3+的抑制作用较明显。
表2 金属离子及螯合剂EDTA对脂肪酶tabI酶活力的影响
Table 2 The effect of metal ions and chelating agent EDTA on the activity of lipase tabI
2.5.4 有机溶剂对脂肪酶tabI酶活力的影响
按照1.7的方法,测定有机溶剂对脂肪酶tabI酶活力的影响,结果如图7所示。叔丁醇和乙醇对脂肪酶tabI的酶活力表现出了明显的促进作用,二甲基亚砜、氯仿和正己烷对脂肪酶tabI的酶活力基本没有影响,丙三醇、二氯甲烷、苯、十二烷和乙醚对脂肪酶tabI 的酶活力有一定的抑制作用,其中苯的抑制作用最明显。
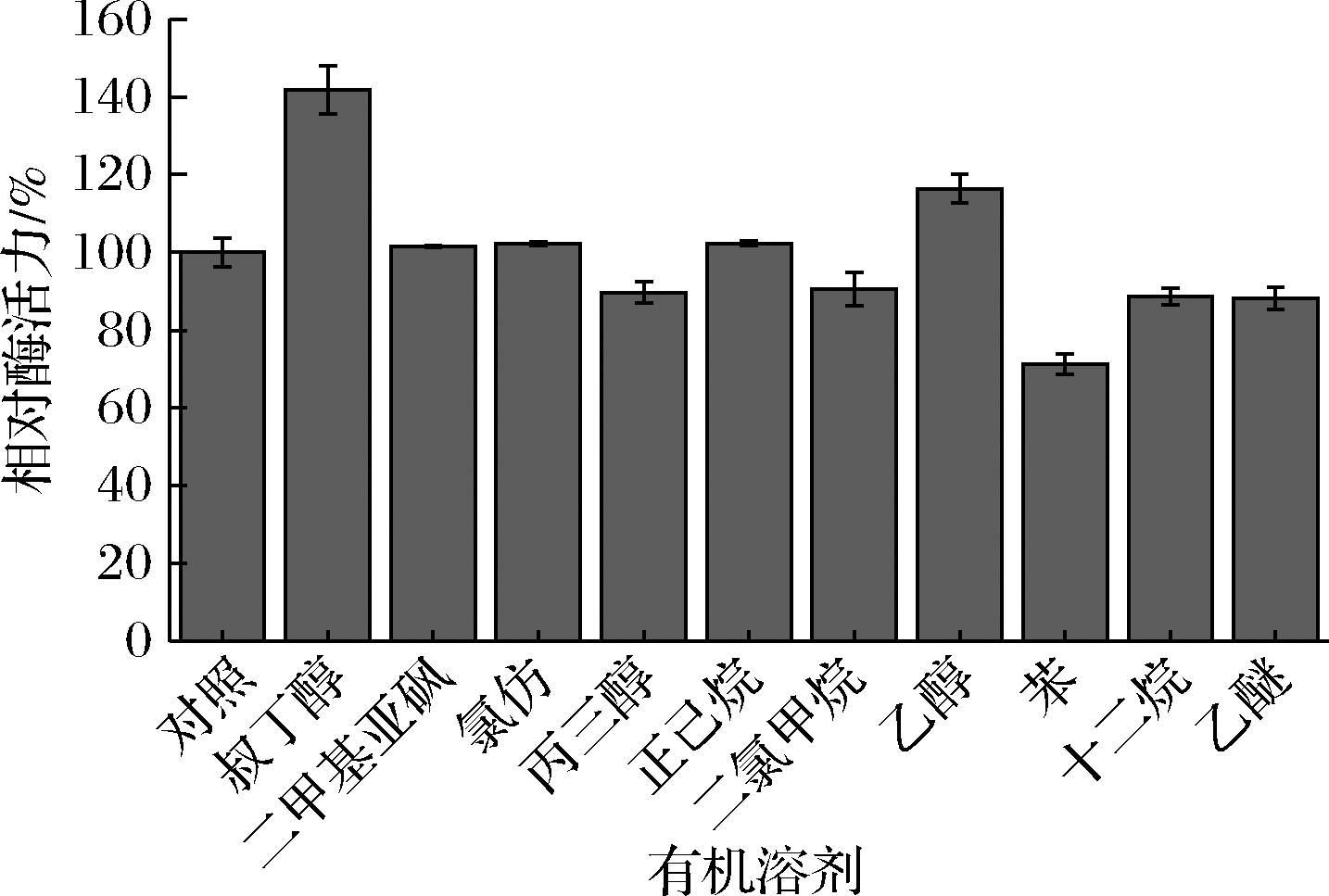
图7 有机溶剂对脂肪酶tabI酶活力的影响
Fig.7 The effect of organic solvents on the activity of lipase tabI
2.6 脂肪酶tabI合成乳酸乙酯条件的优化
按照1.8的方法,优化脂肪酶tabI合成乳酸乙酯的条件,结果如图8、表3所示。
乙醇和乳酸是合成乳酸乙酯的前体物质。由图8-a可知,随着乙醇浓度的升高,乳酸乙酯的合成量先升高后降低,当乙醇浓度为8.775 mol/L 时,乳酸乙酯的合成量达到最高值,为33.965 mg/L。在达到最高值后,随着乙醇浓度的升高,乳酸乙酯的合成量反而减少。可能的原因是当乙醇浓度过高时对脂肪酶tabI的酶活力有抑制作用,使乳酸乙酯的合成量下降。
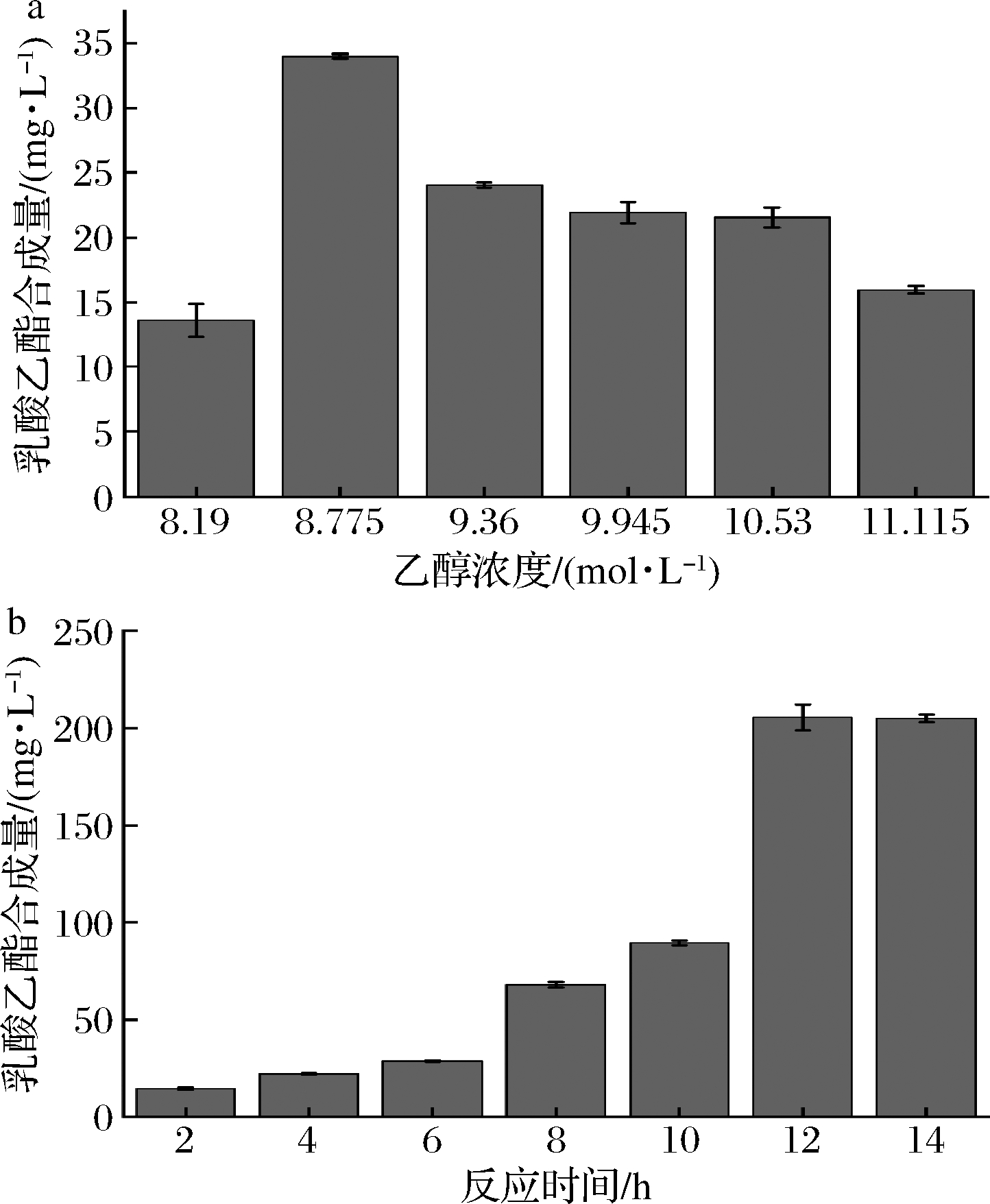
a-最佳乙醇浓度;b-最佳反应时间
图8 脂肪酶tabI合成乳酸乙酯的最佳乙醇浓度和 最佳反应时间
Fig.8 The best ethanol concentration and best reaction time for the synthesis of ethyl lactate by lipase tabI
如表3所示,随着乳酸浓度的升高,反应体系pH降低,乳酸乙酯的合成量呈现先升高后降低的趋势,当乳酸浓度为2.34 mol/L时,乳酸乙酯的合成量最高,为208.49 mg/L。当乳酸的浓度继续升高时,反应体系的pH越来越低,对酶的构象产生影响,脂肪酶tabI活力下降,乳酸乙酯合成量减少。
表3 脂肪酶tabI合成乳酸乙酯的最佳乳酸浓度
Table 3 The optimal concentration of lactic acid for the synthesis of ethyl lactate by lipase tabI

图8-b为反应时间与乳酸乙酯合成量的关系,随着反应时间的增加,乳酸乙酯的合成量逐渐增加,当反应达12 h时,乳酸乙酯的生成量最高,为210.24 mg/L,反应时间为14 h时,乳酸乙酯的生成量为209.97 mg/L,乳酸乙酯的生成量减少0.27 mg/L,与12 h比属误差范围。主要原因是酯化反应为可逆反应,随着时间的推移反应趋于平衡。
综上所述,脂肪酶tabI具有催化合成乳酸乙酯的能力。脂肪酶tabI催化合成乳酸乙酯的最优条件为在酸醇比为1∶3.75下,温度40 ℃、反应时间12 h,乳酸乙酯的合成量为210.24 mg/L。
3 结论与讨论
本文对从老白干大曲中分离出的酯化酶活力较高的黑曲霉菌株H0和H7进行了转录组分析,得到了一个在黑曲霉中基因转录水平较高且功能未知的脂肪酶基因tabI。对该脂肪酶基因进行了分子克隆、异源诱导表达,并首次解析了脂肪酶tabI的酶学性质。经过克隆表达和纯化之后,脂肪酶tabI的蛋白分子质量约为29 kDa,比酶活力为54.34 U/mg。经酶学性质分析表明,脂肪酶tabI在40 ℃、pH 8的条件下,酶活力最高,说明该酶是一种偏碱性的酶。脂肪酶tabI分别在30、40 ℃和pH 7~9下孵育4 h,残余酶活力均在80%以上,表明其具有一定的热稳定性和pH稳定性。该酶催化合成乳酸乙酯的试验表明(表3),在pH 3.5左右时具有一定的催化能力,在最适条件下乳酸乙酯的合成量为210.24 mg/L,证明其在酸性条件下仍具有一定的合成乳酸乙酯的能力,为乳酸乙酯脂肪酶的开发和应用打下了一定基础。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



