刚果红法定量检测酵母β-葡聚糖的方法研究
酵母细胞壁来源的β-葡聚糖(yeast β-glucan, Y β-Glu)分为碱溶性和碱不溶性,碱不溶性酵母β-葡聚糖具有抗肿瘤[1]、抗氧化[2]、改善肠道菌群[3]、提高人体免疫力等作用,在疾病的预防、治疗方面有着潜在的应用价值。酵母β-葡聚糖也是一种大分子物质,具有β-1,3键构成的主链,以及β-1,6键形成的分支,并具有独特的三螺旋空间结构[4],不溶于水、酸、碱。
刚果红(Congo red,CR)是一种阴离子偶氮染料,棕红色、粉状,易溶于水,具有联苯偶氮结构,能与酵母β-葡聚糖三螺旋结构发生特异性结合[5]。有研究表明,酵母β-葡聚糖中每1个3链6螺旋片段中可容纳1分子的刚果红,两者之间可通过氢键和疏水键结合,形成稳定的红色复合物[6-7],并使复合物在可见光区的最大吸收波长发生红移[8-9]。根据此性质可定量检测酵母β-葡聚糖的含量。
酵母β-葡聚糖检测方法有苯酚-硫酸法[10]、酶法[11]等,这些方法都是将多糖分解成葡萄糖分子,然后再换算为β-葡聚糖,忽略了其他多糖杂质的影响,检测结果特异性不好,误差偏大,在工业生产应用中具有一定的局限性。NITSCHKE等[9]建立了刚果红试剂用于检测具有β-1,3-1,6结构的可溶性蘑菇多糖的方法,为具有相似结构的酵母β-葡聚糖的检测提供了借鉴,但酵母β-葡聚糖的不溶性,却妨碍了该方法的直接应用。王志等[12]利用二甲亚砜(dimethyl sulfoxide,DMSO)作为酵母β-葡聚糖的助溶剂,实现了酵母β-葡聚糖溶解,刚果红试剂得以用于酵母β-葡聚糖检测,并建立了相应的检测体系。但是该方法没有对检测的特异性进行研究,不能排除酵母细胞壁中碱溶性β-1,3葡聚糖的干扰,该文报道的可完全溶解β-葡聚糖的最低DMSO浓度,也与我们的研究结果有较大差异。此外缓冲液的选择、检测限等也没有明确说明,影响了其实验的重现性。所以在此基础之上,对刚果红与酵母β-葡聚糖的反应体系进行进一步的优化,明确检测限以确定适用范围,增设干扰物实验确定检测的特异性,完善刚果红试剂-酵母β-葡聚糖的检测方法,以期对酵母β-葡聚糖的相关研究提供参考。
1 材料与方法
1.1 主要材料
1.1.1 主要试剂
酵母β-葡聚糖、甘露聚糖,Sigma公司,酵母碱溶性β-1,3葡聚糖,Macklin公司;刚果红,合肥博美生物科技公司;NaH2PO4、Na2HPO4、柠檬酸、柠檬酸三钠、醋酸、醋酸钠、二甲基亚砜(DMSO),天津市科密欧化学试剂有限公司。
质量分数为0.01%刚果红溶液(用pH 7.5的0.1 mol/L NaH2PO4-Na2HPO4缓冲液溶解)。
酵母β-葡聚糖备用液:准确称量50 mg酵母β-葡聚糖,加入10 mL体积分数为90%的DMSO溶液,于70 ℃的水浴锅中加热3 h助溶,即得。
1.1.2 仪器与设备
UV-1750型紫外-可见分光光度计,岛津实验器材有限公司;HH-1 J型水浴锅,常州国旺仪器制造有限公司;PHS-2F型酸度计,上海仪电科学仪器股份有限公司。
1.2 实验方法
1.2.1 反应体系
总反应体系为4 mL,先加入拟定量的酵母β-葡聚糖溶液,再用磷酸盐缓冲液补足至2 mL,最后加入2 mL刚果红试剂,以不加酵母β-葡聚糖的情况为对照,测定吸光度值。
1.2.2 检测波长与吸收差谱测定
将酵母β-葡聚糖备用液用蒸馏水稀释至终质量浓度为200 μg/mL,取1 mL于试管中,加磷酸盐缓冲液1 mL,再加2 mL刚果红试剂;以不加酵母β-葡聚糖的情况为对照,进行全波段光谱扫描。
1.2.3 反应条件的优化
1.2.3.1 最适pH对反应的影响
考察pH为6.5、7.0、7.5、8.0、8.5的NaH2PO4-Na2HPO4缓冲液对反应体系的影响,反应体系参照1.2.1,其中酵母β-葡聚糖的加入量为200 μg;在25 ℃下反应15 min,测定540 nm下的吸光度值。
1.2.3.2 最适温度对反应的影响
考察不同温度对反应的影响,设定反应温度为20、30、40、50、60 ℃,反应体系参照1.2.1,其中酵母β-葡聚糖的加入量为200 μg;在pH为7.5的NaH2PO4-Na2HPO4缓冲液中反应15 min,测定540 nm下的吸光度值。
1.2.3.3 最适时间对反应的影响
反应体系参照1.2.1,其中酵母β-葡聚糖的加入量为200 μg;在pH为7.5的NaH2PO4-Na2HPO4缓冲液中反应,反应温度为25 ℃,考察不同反应时间对实验结果的影响,选取反应时间为5、10、15、20、25 min,分别测定540 nm下的吸光度值。
1.2.4 缓冲液种类对反应的影响
对比pH 7.5的NaH2PO4-Na2HPO4缓冲液、C6H8O7·H2O-C6H5 Na3O7·2H2O缓冲液、CH3COOH-CH3COONa·3H2O缓冲液对反应体系的影响,反应体系参照1.2.1,其中酵母β-葡聚糖的加入量为200 μg,通过全波段光谱扫描确定缓冲液种类对反应的影响。
1.2.5 DMSO对酵母β-葡聚糖溶解的影响
准确称取酵母β-葡聚糖10 mg,加入10 mL不同体积分数(选择为40%、50%、60%、70%、80%、90%、100%)的DMSO溶液,在70 ℃水浴锅中处理3 h,根据酵母β-葡聚糖与刚果红的反应结果考察酵母β-葡聚糖在DMSO中的溶解情况。
1.2.6 刚果红的检测限测定
最低检测限:将酵母β-葡聚糖备用液用蒸馏水稀释至终质量浓度20 μg/mL,反应体系参照1.2.1,在试管中分别加入0、2、4、6、8、10、12 μg的酵母β-葡聚糖,测定540 nm下的吸光度值。
最大检测限:将酵母β-葡聚糖备用液用蒸馏水稀释至终质量浓度1 mg/mL,反应体系参照1.2.1,在试管中分别加入0、0.2、0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8、2.0 mg的酵母β-葡聚糖,测定540 nm下的吸光度值。
1.2.7 酵母β-葡聚糖的标准曲线
将酵母β-葡聚糖用蒸馏水稀释至终质量浓度200 μg/mL,按照表1加样,考察不同酵母β-葡聚糖浓度与吸光度的对应关系。
表1 刚果红法染色酵母β-葡聚糖实验组 单位:mL
Table 1 Congo red staining yeast β-glucan experimental group

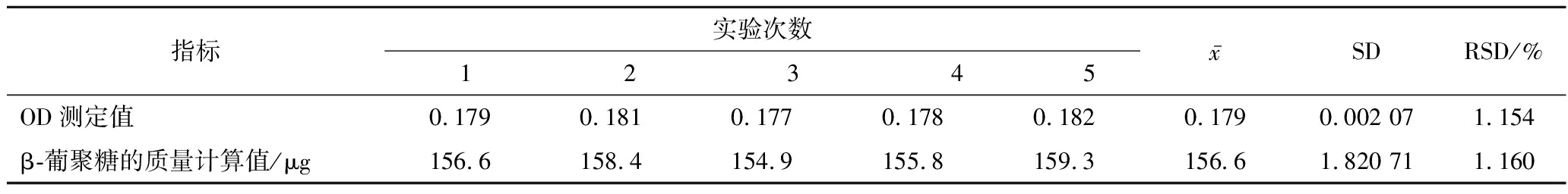
1.2.8 精密度实验
将酵母β-葡聚糖备用液配制质量浓度为200 μg/mL。反应体系参照1.2.1,分别在5组试管中加入酵母β-葡聚糖160 μg,测定吸光度。代入标准方程,计算相对标准偏差(relative standard deviation,RSD)。
1.2.9 回收率实验
配制质量浓度为200 μg/mL的酵母β-葡聚糖备用液。反应体系参照1.2.1。每次加入酵母β-葡聚糖的量为200 μg,测定5次。计算回收率和RSD。
1.2.10 干扰物实验
以200 μg/mL酵母β-葡聚糖为对照品,配制200 μg/mL碱溶性β-1,3葡聚糖和甘露聚糖为干扰物,将干扰物加入反应体系,测定吸光度3次并取平均值,以评价干扰效果和检测方法准确性。
2 结果与分析
2.1 吸收波长和吸收差谱的确定
将酵母β-葡聚糖和刚果红反应的复合物进行全波段光谱扫描,以不加酵母β-葡聚糖的情况为对照,如图1所示。
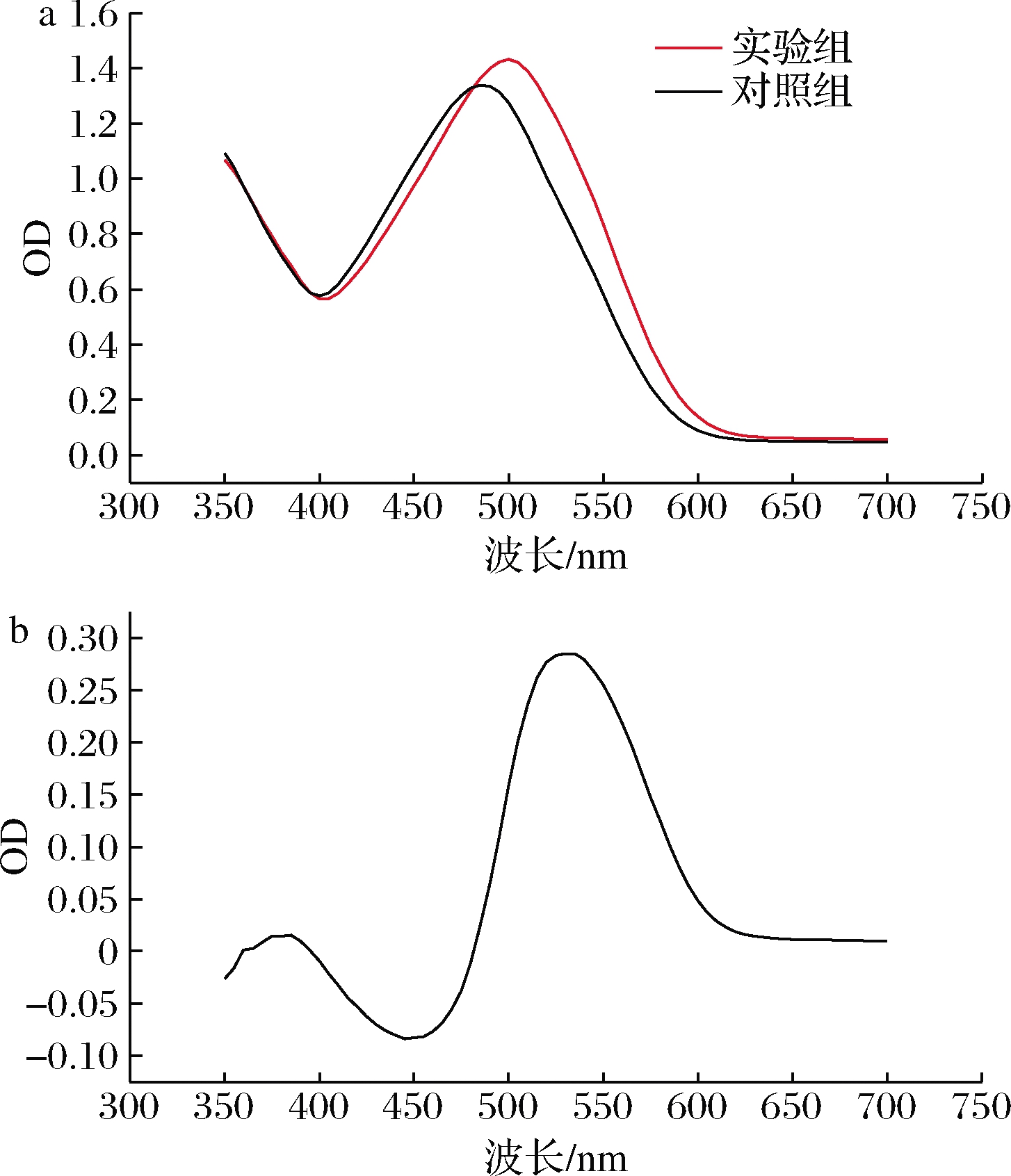
a-吸收波谱;b-吸收差谱
图1 反应复合物的全波段光谱扫描
Fig.1 Full-band spectral scanning of the reaction complex
在刚果红体系中加入酵母β-葡聚糖后吸收光谱发生了红移现象。由吸收差谱可得最大检测吸收波长为540 nm,故此后反应体系均采用540 nm作为测定波长。
2.2 不同因素对反应的影响
2.2.1 pH对反应的影响
刚果红是一种酸碱指示剂,其pH变色范围为3.5~5.2,与β-葡聚糖反应时应在刚果红的非变色范围内进行测定,反应pH与吸光度的关系如图2-a所示:在pH 6.5~8.5内,检测结果差异不大,F=2.455,P=0.114>0.05,pH条件为反应的非显著性因素。因pH 7.5时吸光度值最大,故选择缓冲液pH为7.5。
2.2.2 温度对反应的影响
在不同温度下(20~60 ℃)反应,测定吸光度,测定结果如图2-b所示,在20~30 ℃时吸光度变化较为平缓,之后吸光度随着温度的升高迅速下降。温度升高时,可能会引起1,3-β-葡聚糖链发生构象变化,导致其结合位点容纳的刚果红分子的数量减少[13],故实验选择20 ℃为反应温度。
2.2.3 时间对反应的影响
时间与吸光度的关系如图2-c所示,随着反应时间增长,反应的吸光度逐渐升高后趋于平缓。当反应时间为15 min时,吸光度达到最大值为0.231,故选择反应时间为15 min。β-葡聚糖与刚果红结合后的吸收光谱是平衡时游离染料和复合物的吸收光谱之和,这是一个动态可逆反应过程,随着时间的变化,其反应会逐渐趋于平衡[14]。
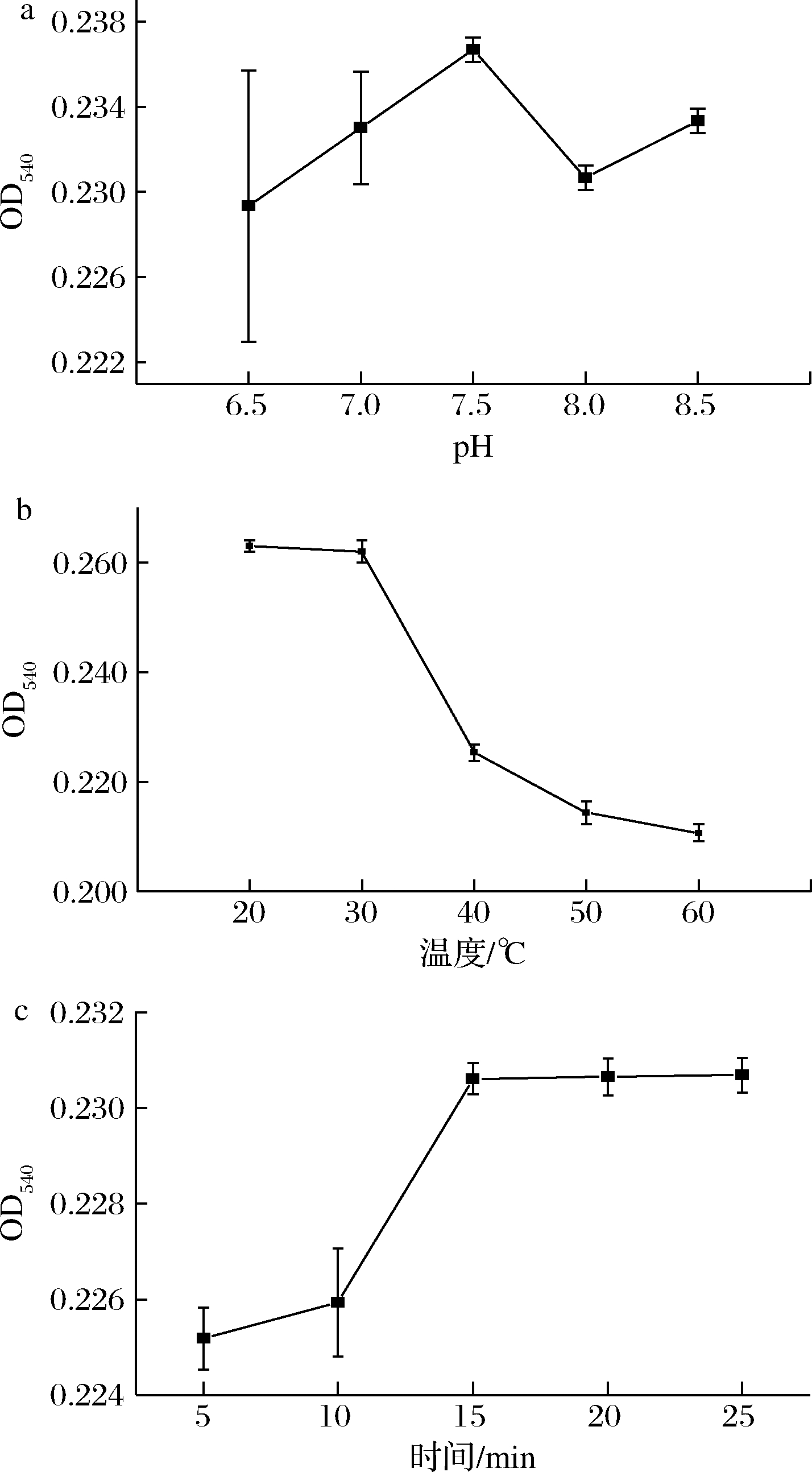
a-pH;b-温度;c-时间
图2 不同因素对反应的影响
Fig.2 The influence of different factors on the reaction
2.3 不同种类缓冲液的选择结果
在540 nm处,吸光度值由上至下依次为,磷酸缓冲液、柠檬酸缓冲液、醋酸缓冲液、刚果红对照液。如图3所示。
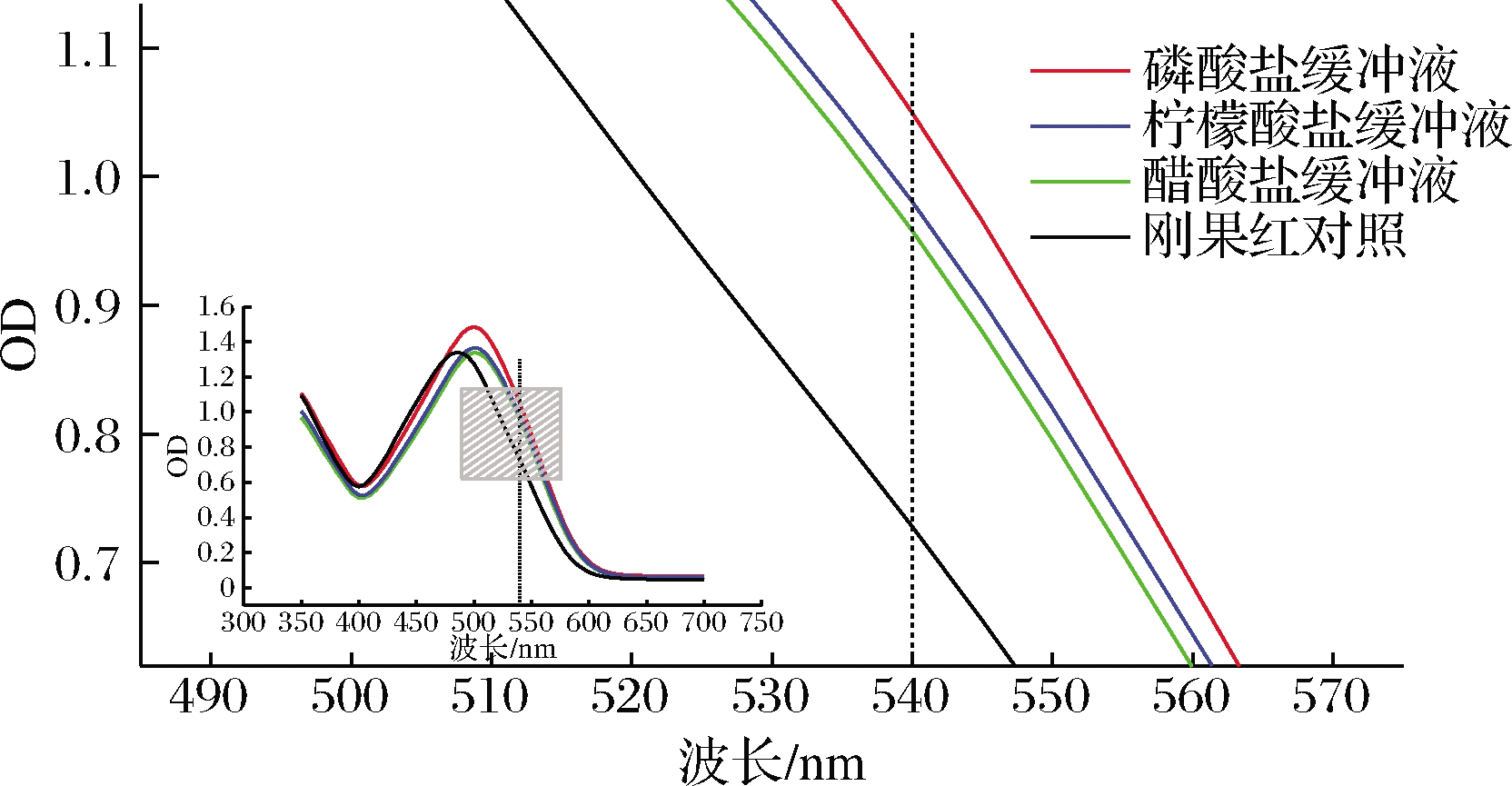
图3 不同缓冲液对吸光度的影响
Fig.3 The influence of different buffers on absorbance
实验结果显示,盐溶液可能会导致β-葡聚糖无序的空间结构向有序转变,而有序的能更好地与刚果红结合[14]。而在磷酸缓冲液中酵母β-葡聚糖与刚果红结合更为灵敏,其结合度要高于其他几种缓冲液。
2.4 不同体积分数DMSO处理酵母β-葡聚糖的结果分析
用不同体积分数的DMSO处理酵母β-葡聚糖,其浓度与吸光度的关系如图4所示。随着DMSO体积分数增加,溶解的酵母β-葡聚糖逐渐增多,直接观测法可明显看出从50%~90%悬浮物逐渐减少,吸光度与DMSO体积分数接近线性关系,说明此浓度范围的DMSO溶液对酵母β-葡聚糖的空间结构没有破坏或破坏程度极小;在90%~100%时,溶液呈澄清透明状,说明酵母β-葡聚糖被完全溶解,但吸光度有所降低,可能与酵母β-葡聚糖结构被破坏有关。本实验结果与其他文献报道[15]的DMSO能破坏酵母β-葡聚糖结构说法有所不同,可能是实验所使用的酵母β-葡聚糖的分子质量不同所致,其具体原因有待进一步探究。
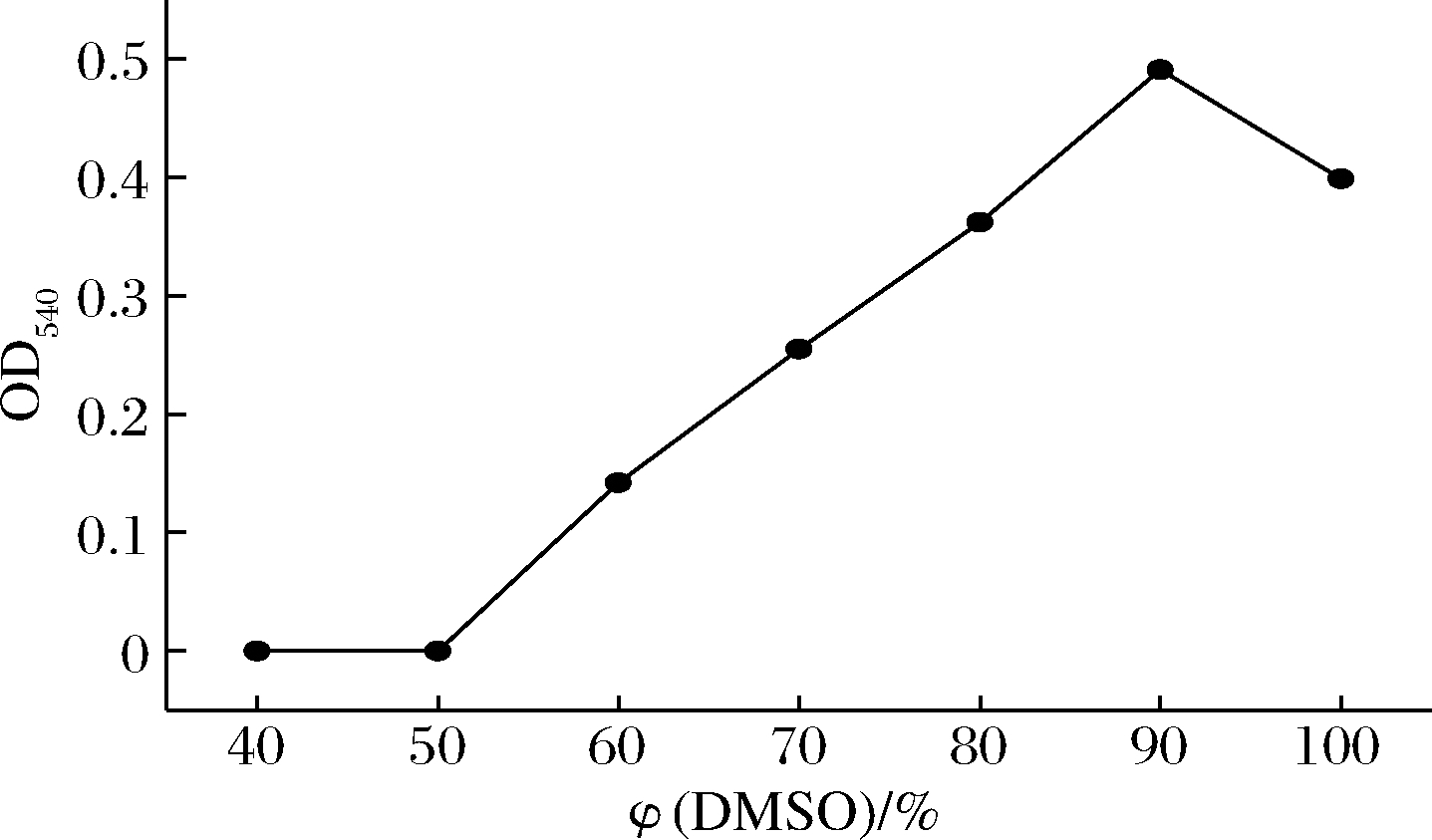
图4 不同含量DMSO与吸光度的关系
Fig.4 Relationship between different DMSO and absorbance
2.5 刚果红检测限结果分析
对酵母β-葡聚糖的最大检测限和最小检测限进行了实验分析,酵母β-葡聚糖的含量与吸光度关系如图5所示。酵母β-葡聚糖的含量为0~4 μg时,其颜色反应不足于检测出来;当含量大于4 μg,吸光度随着含量增加而接近线性关系。当含量达到1 600 μg时,吸光度逐渐趋于平稳,其中线性较好的范围是4~200 μg。2 mL的0.1 mg/mL刚果红试液即为0.2 mg,可与4~1 600 μg内酵母β-葡聚糖的发生反应。说明酵母β-葡聚糖的三螺旋结构片段与刚果红分子结合有上限,并不是无限结合,其结合度与氢键和疏水键有关。

图5 刚果红检测限
Fig.5 Limit of detection of Congo red
2.6 标准曲线
按照1.2.7步骤进行实验,通过Origin Pro 8.5软件拟合回归方程,酵母β-葡聚糖在4~200 μg内有良好的线性关系,回归方程为:Y=0.001 15X-0.001 14,R2=0.998 6。
2.7 精密度实验结果
对同一批样品进行重复实验,对该方法进行精密度验证。分别在5组试管中加入相同量的酵母β-葡聚糖,测定吸光度,结果见表2,实验结果RSD为1.154%,表明检测方法重复性良好,可作为酵母β-葡聚糖检测方法使用。
表2 精密度实验结果
Table 2 Precision test results
2.8 回收率实验结果
在酵母β-葡聚糖样品中加入不同量的标准品,测定回收率,实验结果如表3所示,其平均回收率为100.32%,RSD为1.11%。准确度高,可满足一般检测的需要。
表3 回收实验结果
Table 3 Experimental results of sampling recovery

2.9 干扰物实验结果
以酵母β-葡聚糖为对照组,在干扰组中分别加入β-1,3葡聚糖和甘露聚糖,测定干扰率,实验结果如表4所示。
表4 干扰物实验结果
Table 4 Experimental results of interference
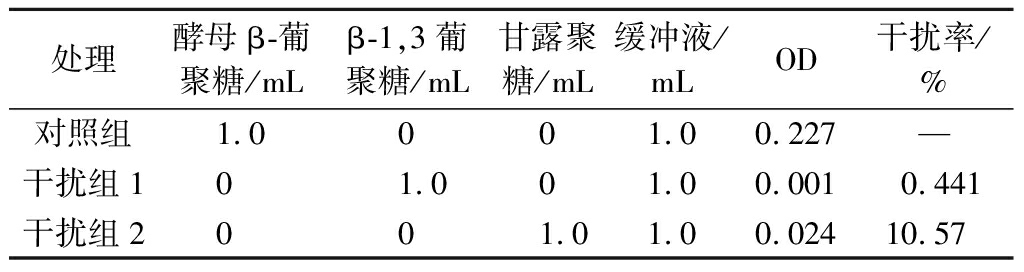
结果显示,β-1,3葡聚糖干扰率(0.587%)<精密度(RSD=1.154%),说明β-1,3葡聚糖对检测的结果影响较小;而甘露聚糖对反应有较大的影响,但是在实际样品的检测中,经过预处理后的甘露聚糖已经被去除,并不影响测定结果。
3 讨论与结论
实验利用刚果红与酵母β-葡聚糖特异性结合的性质,对酵母β-葡聚糖进行定量检测,避免了传统检测方法间接、多步测定和误差偏大的缺点,显示出一定的优越性。对刚果红和酵母β-葡聚糖的反应体系和反应条件进行优化,结果显示,0.1 mol/L,pH 7.5磷酸缓冲液使反应灵敏度提高,最低检出限提高为4 μg;温度影响刚果红和酵母β-葡聚糖两者的结合度,在20 ℃下,结合度最大。15 min时,反应可以达到平衡。在此优化条件下进行验证实验。精密度RSD为1.160%,平均回收率为100.32%,相比优化前具有更好的精密度和更高的回收率,测定结果准确、稳定;干扰性实验显示,反应不受碱溶性β-1,3葡聚糖的干扰,而受甘露聚糖影响较大。酵母β-葡聚糖为不溶性物质,经过预处理以及中间的制备过程,可溶性的甘露聚糖几乎被完全去除,几乎无法检出。因此,按照制备过程得到的酵母β-葡聚糖样品可以忽略甘露聚糖对反应的影响。但是对于市售的酵母细胞壁产品而言,其中存在较多的甘露聚糖,检测前的预处理极为必要,须去除甘露聚糖才可以确保检测的准确性。
DMSO溶解实验说明,有效溶解酵母β-葡聚糖需要较高浓度的DMSO,酵母β-葡聚糖溶解度与DMSO作助溶剂时浓度间存在近似的线性关系,由此推测高浓度的DMSO并没有对酵母β-葡聚糖的结构造成破坏或者破坏极小,这与其他文献报道[15]的结果存在一定的差异,所以还需进行更深一步探讨。
本实验完善了刚果红与酵母β-葡聚糖反应的具体条件,使之更具可操作性,对酵母细胞壁产品中的β-葡聚糖的检测具有参考价值。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



