黑果腺肋花楸果微乳系统薄层色谱分析及生物自显影抗氧化活性研究
黑果腺肋花楸(Aronia melanocarpa (Michx.) Elliott),又称不老莓,最早起源于北美东北部,20世纪90年代引入我国,在食用、药用、园林、生态方面均应用广泛[1],2018年9月国家卫健委正式批准黑果腺肋花楸果为新食品原料[2]。黑果腺肋花楸果实中主要化学成分为原花青素、花色苷、黄酮、酚酸等[3],据报道黑果腺肋花楸果实中花青素、黄酮、多酚含量远超其他浆果,甚至是已知植物中含量最高的[4]。近年来发现黑果腺肋花楸果实及提取物在抗氧化、抗突变、抗炎、抗肿瘤,抗糖尿病以及防治心血管疾病等方面都有显著作用[5-8]。
已有文献报道了采用pH示差法[9],高效液相色谱[10]测定黑果腺肋花楸果中花色苷含量;紫外可见分光光度法[11]测定总黄酮含量;Folin-Ciocalteu法[12]测定酚酸类成分,但是到目前为止,还未见高效薄层色谱法同时测定黑果腺肋花楸果中花色苷、黄酮、酚酸类成分的报道。
微乳液是由表面活性剂、助表面活性剂、油相和水相按适当比例自发生成的有增溶作用的热力学稳定体系[13],以微乳液为展开剂进行的薄层色谱分析称为微乳色谱,目前已应用于黄酮、皂苷、生物碱和多糖类等成分的分离鉴定[14]。聚酰胺分子中的酰胺键可与酚类、酸类、醌类等化合物形成氢键缔合而产生吸附解析,因此聚酰胺薄膜已成为黄酮类、酚类、有机酸、生物碱类等薄层分析方法中的常用固定相[15]。本研究在前期实验中考察了传统硅胶薄层色谱和聚酰胺薄膜结合微乳系统薄层色谱,发现聚酰胺薄膜结合微乳系统薄层色谱比传统硅胶薄层色谱灵敏度和分离效率要高,重现性好。因此本研究采用聚酰胺-微乳薄层系统结合高效薄层色谱法(high performance thin layer chromatography,HPTLC),测定黑果腺肋花楸果中多种成分含量,通过紫外-可见分光光度法(ultraviolet-visible spectroscopy, UV-Vis)测定其对DPPH自由基的清除能力,通过薄层生物自显影技术判定抗氧化活性成分。
1 材料与方法
1.1 仪器与设备
半自动点样仪、SCANNER 3型薄层色谱扫描仪、薄层色谱数码成像系统,瑞士CAMAG;超声波清洗仪(150 W,40 kHz),昆山市超声仪器有限公司;万分之一分析天平,上海梅特勒-托利多仪器有限公司。
1.2 材料与试剂
黑果腺肋花楸果冻干粉,经鉴定为蔷薇科腺肋花楸属植物黑果腺肋花楸的果实,新疆埃乐欣药业有限公司。矢车菊素-3-O-葡萄糖苷(cyanidin-3-O-glucoside,C3G)、金丝桃苷、矢车菊素-3-O-阿拉伯糖苷(cyanidin-3-O-arabinofuranoside,C3A),北京索莱宝科技有限公司;绿原酸、新绿原酸、维生素C,上海源叶生物科技有限公司;1,1-二苯基苦基苯肼,梯希爱上海化成工业发展有限公司;其余实验所用试剂均为分析纯。
1.3 薄层扫描方法
1.3.1 溶液的制备
1.3.1.1 C3G、金丝桃苷、绿原酸对照品溶液的制备
精密称取C3G、金丝桃苷及绿原酸对照品适量,加甲醇定容至容量瓶中,配成C3G、金丝桃苷、绿原酸系列质量浓度分别为89.42、149.04、248.40、414.00、690.00 μg/mL;5.42、9.03、15.05、25.08、41.80 μg/mL;25.79、42.98、71.64、119.40、199.00 μg/mL的混合溶液,摇匀后经0.22 μm滤膜过滤后作为对照品溶液。
1.3.1.2 供试品溶液的制备
称取黑果腺肋花楸果冻干粉1.00 g,置棕色容量瓶中,以60%甲醇(经0.5% HCl调节pH至2~3)为溶剂,料液比1∶10(g∶mL),40 ℃条件下超声提取30 min,冷却至室温后过滤,滤液经0.22 μm滤膜过滤后作为供试品溶液。
1.3.2 色谱程序
使用CAMAG Linomat 5半自动斑点采样器,对聚酰胺薄膜条状点样,采样器的载气为N2,释放速率为150 nL/s,对照品与供试品溶液均为2 μL,带长6 mm,轨道距离8 mm,左右边距50 mm,条带间距9 mm。以质量分数75%含水量微乳-甲酸(9∶1,mL∶mL)为展开剂,在展开缸中饱和10 min后展开,取出,晾干,花色苷类成分在白光下检视,黄酮类,酚酸类成分先喷2-氨基乙酯二苯基硼酸(2-aminoethoxydiphenyl borate,2-APB)甲醇溶液,后喷聚乙二醇(polyethylene glycol,PEG)400甲醇溶液,105 ℃加热后置于366 nm紫外灯下检视。使用Reprostar 3薄层色谱仪分别在白光和366 nm紫外灯下检查和捕获样品图像。使用CAMAG TLC 3扫描仪对对照品和样品进行全波长扫描,距底部的扩展距离为90和8 mm,狭缝宽度为6 mm×0.3 mm,扫描速度为20 mm/s。用WinCATS4.04版本TLC在350和550 nm下扫描该聚酰胺薄膜,狭缝宽度为4 mm×0.3 mm,扫描速度为20 mm/s。
1.3.3 方法学考察
对建立的聚酰胺结合微乳系统薄层色谱方法进行方法学考察,包括线性、日内、日间精密度、稳定性、重复性、耐用性、回收率。
1.3.4 含量测定
对不同批次黑果腺肋花楸果冻干粉样品中C3G、金丝桃苷及绿原酸进行含量测定。
1.4 UV-Vis法测定总抗氧化活性
1.4.1 溶液的制备
1.4.1.1 维生素C对照品溶液的制备
称取维生素C对照品6.54 mg,置于10 mL容量瓶中,用甲醇配成质量浓度为0.654 mg/mL的对照品溶液。经适当稀释分别配成6.54、13.08、19.62、26.16、39.24、52.32、65.40 μg/mL的溶液。
1.4.1.2 供试品溶液的制备
根据实验需要将1.3.1.2中供试品溶液经稀释配成质量浓度分别为0.1、0.2、0.4、0.6、0.8、1.0、1.2 mg/mL的供试品溶液。
1.4.1.3 DPPH溶液的制备
称取DPPH对照品4.52 mg,置于100 mL棕色容量瓶中,用甲醇配成质量浓度为0.045 2 mg/mL的溶液。
1.4.2 DPPH自由基清除率测定
吸取3 mL DPPH溶液与1 mL甲醇混匀后,在最大吸收波长516 nm处测定吸光度A0;吸取DPPH溶液3 mL加入系列对照品或供试品溶液1 mL混匀,避光反应0.5 h后,在516 nm处测定吸光度Ai;空白为甲醇3 mL与相对应系列对照品或供试品溶液1 mL混匀,避光反应0.5 h后在516 nm处测定吸光度Aj,按公式(1)计算清除率(S)。
(1)
1.5 薄层生物自显影(TLC Biography,TLC-Bio)分析黑果腺肋花楸果提取物中抗氧化活性成分
1.5.1 溶液的制备
精密称取C3A,新绿原酸对照品适量,加甲醇配成质量浓度为0.2、0.263 mg/mL对照品溶液。
1.5.2 TLC-Bio测定黑果腺肋花楸果提取物中抗氧化活性成分
分别吸取C3G、C3A、新绿原酸、金丝桃苷、绿原酸混合对照品溶液,黑果腺肋花楸供试品溶液各2 μL,按1.3.2方法操作,点样于a,b两张聚酰胺薄膜后,展开取出,晾干,不进行扫描。将聚酰胺薄膜a先在白光下检视,再喷显色剂,先喷2-APB,后喷PEG400,晾干后置紫外366 nm光下检视,聚酰胺薄膜b晾干后直接喷DPPH甲醇溶液,直到呈现紫色背景,在白光下检视。
2 结果与分析
2.1 薄层扫描最大吸收波长的确定
扫描仪对对照品和供试品进行扫描后发现黑果腺肋花楸果供试品溶液斑点与对照品斑点比移值相同,光谱图最大吸收波长一致(图1),C3G为550 nm,绿原酸为340 nm,金丝桃苷为370 nm,且波形一致,可以认为是同一物质。绿原酸与金丝桃苷在350 nm处均有较大吸收,后续实验采用双波长法分别在350、550 nm处对绿原酸,金丝桃苷和C3G进行分析。

a-C3G;b-金丝桃苷;c-绿原酸
图1 最大吸收光谱和化学结构图
Fig.1 The maximum absorption spectrum and chemical structure
2.2 方法学结果
2.2.1 线性
分别吸取1.3.1.1中C3G、金丝桃苷及绿原酸系列浓度对照品溶液,按1.3.2方法操作,以浓度为x轴,峰面积为y轴,得到对照品C3G,金丝桃苷,绿原酸的线性回归方程,见表1。
表1 方法的线性关系考察表
Table 1 Method of linear relation investigation table

2.2.2 日内间精密度
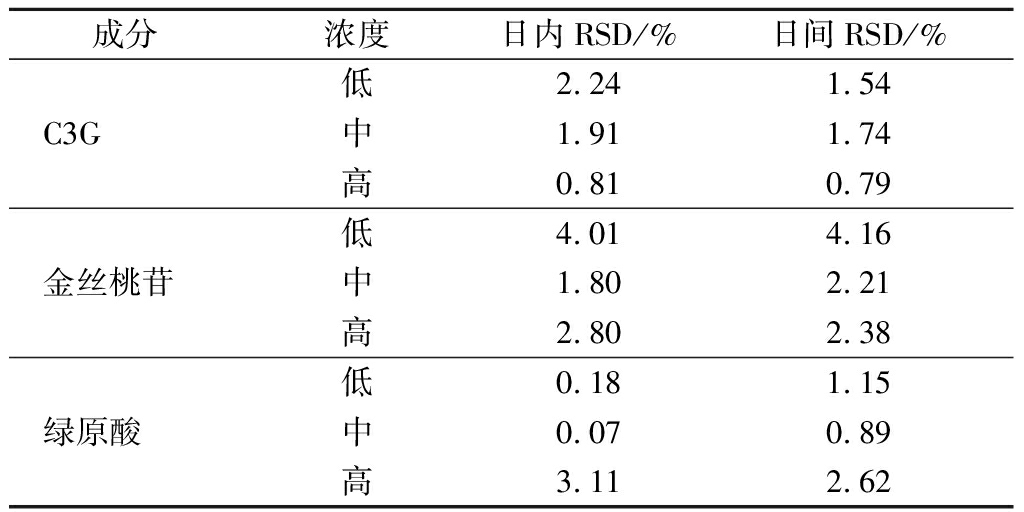
分别吸取C3G、金丝桃苷及绿原酸的低、中、高浓度对照品溶液,各重复3次点于聚酰胺薄膜上,按1.3.2方法操作,测定C3G、金丝桃苷、绿原酸峰面积计算日内间精密度,以相对标准偏差(relative standard deviation,RSD)表示。日内和日间精密度的RSD值如表2所示,结果表明精密度良好。
表2 日内、日间精密度考察表
Table 2 Intraday and inter-day precision investigation table
2.2.3 稳定性
按1.3.2方法操作,吸取混合对照品溶液点样(n=6)于同一聚酰胺薄膜上,分别记录C3G、金丝桃苷、绿原酸在0、2、4、6、8、12、24 h内峰面积并计算RSD,见表3,结果表明稳定性良好,C3G、金丝桃苷、绿原酸RSD均<3%。
表3 稳定性试验结果
Table 3 Stability test results

2.2.4 重复性
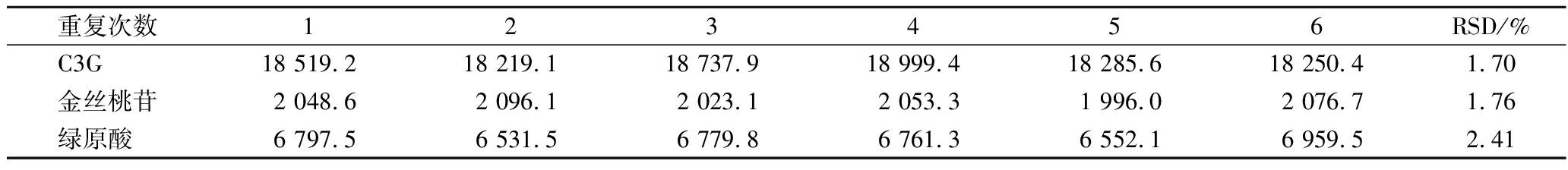
按1.3.1.2提取同一批黑果腺肋花楸冻干果粉溶液(n=6),按1.3.2方法操作,记录供试品中C3G、金丝桃苷、绿原酸峰面积,经计算RSD均<3%,重复性试验符合要求(表4)。
表4 重复性试验结果
Table 4 Repeatability test results
2.2.5 耐用性
按1.3.2方法操作,改变试验条件包括流动相比例(±0.1 mL)、饱和时间(±2 min)、扫描波长(±2 nm),记录峰面积标准偏差(standard deviation,SD)和RSD。通过对展开剂比例、饱和时间、扫描波长进行轻微变动考察发现RSD均<3%,结果见表5。
表5 耐用性试验结果
Table 5 Durability test results

2.2.6 回收率
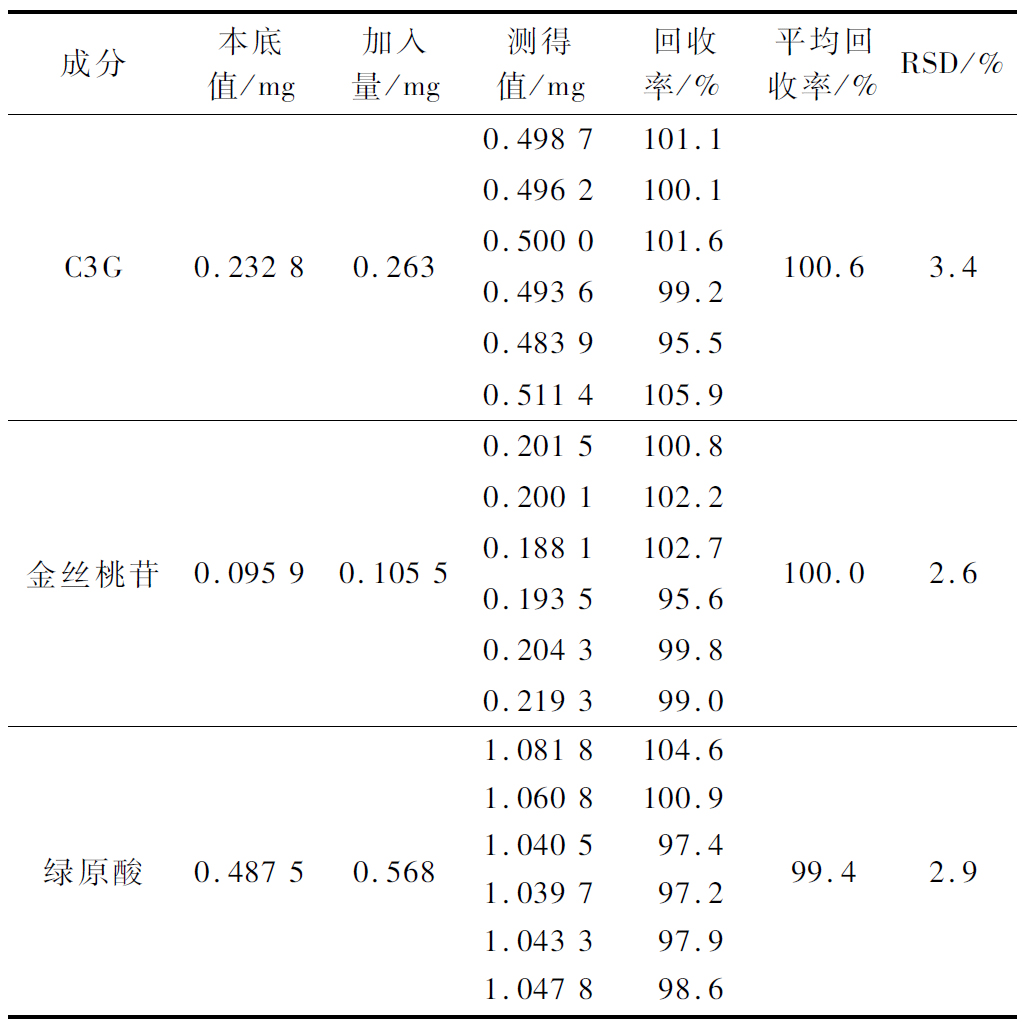
分别吸取供试品溶液适量,加入相当于C3G、金丝桃苷、绿原酸0.263、0.105 5、0.568 mg的对照品溶液,混合均匀。按1.3.2方法操作,结果见表6,C3G、金丝桃苷、绿原酸平均回收率分别为100.6%、100.0%、99.4%;RSD分别为3.4%、2.6%、2.9%,表明该方法回收率良好。
表6 回收率试验结果
Table 6 Recovery test results
2.3 含量测定
按1.3.1.2制备不同批号黑果腺肋花楸冻干果粉溶液(n=3),吸取4批供试品溶液点于同一聚酰胺薄膜上,通过对比对照品C3G、金丝桃苷和绿原酸与样品中相应斑点的Rf值(分别为0.42、0.33、0.51)确定供试品中相应峰,采用外标法测定4批供试品中C3G、金丝桃苷、绿原酸含量(图2、表7)。

S-混标:A-C3G;B-绿原酸;C-金丝桃苷; S1~S4:四批黑果腺肋花楸果
图2 四批黑果腺肋花楸果薄层色谱图
Fig.2 Thin-layer chromatogram of four batches of black chokeberry
表7 样品含量测定结果 单位:mg/g
Table 7 Results of sample content determination

2.4 DPPH自由基清除率结果
2.4.1 不同浓度维生素C对DPPH自由基的清除率
由表8可知,维生素C清除50%DPPH自由基质量浓度约在14 μg/mL,从图3看出维生素C对DPPH自由基的清除能力与浓度相关,一定范围内DPPH自由基清除率随维生素C浓度增加而增大。文献也多用此方法测定抗氧化能力,一定程度上表明本方法测定抗氧化能力是可行的。
2.4.2 不同浓度黑果腺肋花楸果对DPPH自由基的清除率
由表9可知,黑果腺肋花楸果提取物浓度约为0.18 mg/mL能清除50%的DPPH自由基,从图4可看出,清除率随黑果腺肋花楸果提取物浓度增大而增加,浓度达1.2 mg/mL时,清除率为95.90%。
表8 维生素C对DPPH清除结果
Table 8 The DPPH scavenging rate of vitamin C
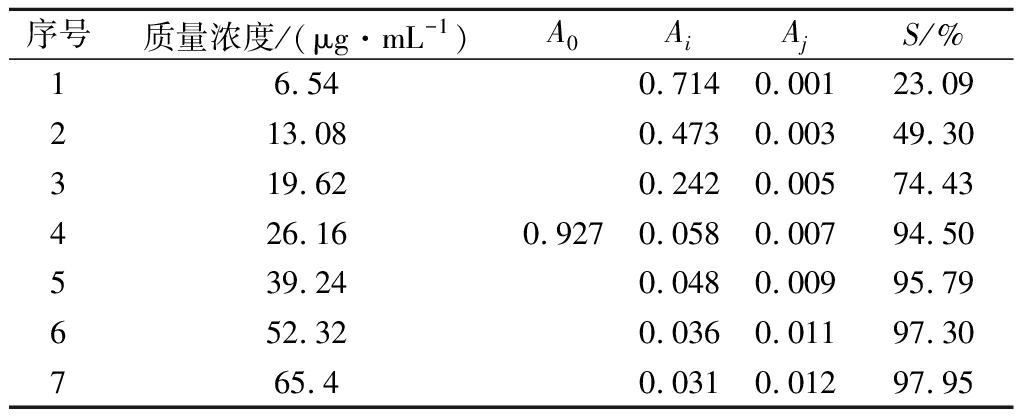

图3 维生素C对DPPH自由基的清除曲线
Fig.3 The Vc scavenging ability toward DPPH
表9 黑果腺肋花楸果对DPPH清除结果
Table 9 The DPPH scavenging rate of black chokeberry
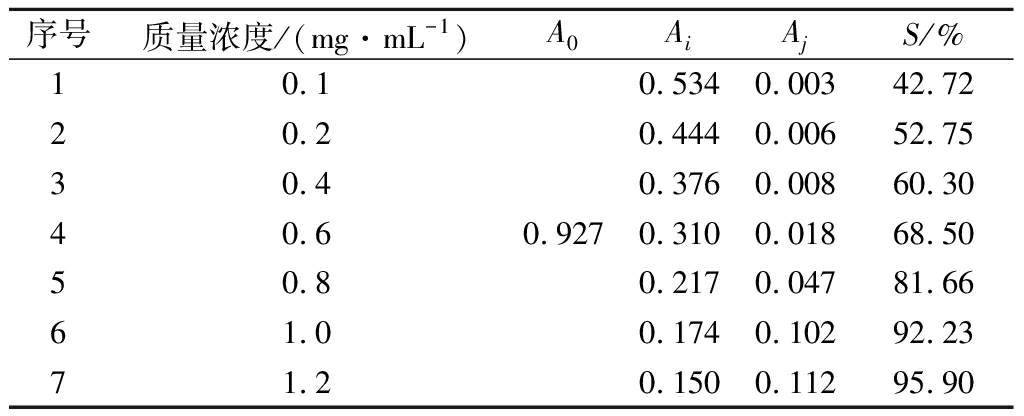
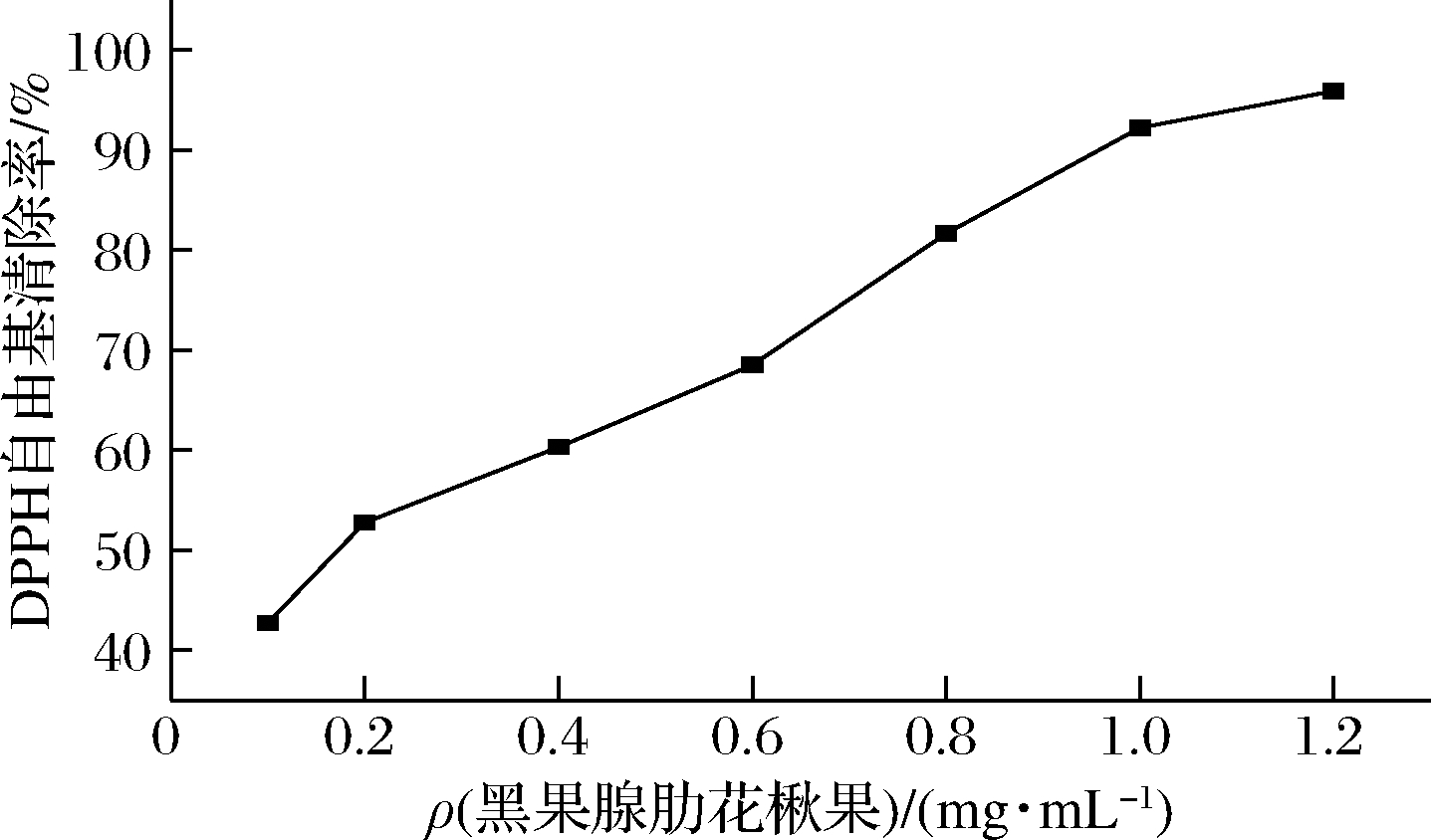
图4 黑果腺肋花楸果对DPPH自由基的清除曲线
Fig.4 Scavenging ability of black chokeberry toward DPPH
2.5 TLC-Bio分析黑果腺肋花楸的抗氧化活性成分
由图5可知,薄层板无抗氧化活性,呈紫色背景,而对照品和供试品显现黄白色斑点,显示具有良好的抗氧化活性,说明黑果腺肋花楸中C3G、C3A、金丝桃苷、绿原酸、新绿原酸都有不同程度的抗氧化活性,除此之外供试品中还含有其他未知抗氧化活性成分,有待于进一步分离鉴定。

a-普通色谱图(Ⅰ白光;Ⅱ 紫外366nm);b-生物自显影色谱图 A-C3G;B-C3A;C-新绿原酸;D-绿原酸;E-金丝桃苷
图5 生物自显影色谱图
Fig.5 TLC-Bio chromatograms
3 结论与讨论
文献报道了黑果腺肋花楸果富含花色苷、黄酮、酚酸类成分,前期实验先采用硅胶薄层色谱与聚酰胺-微乳薄层色谱鉴别指认了其中含有C3G、金丝桃苷、绿原酸、芦丁,发现聚酰胺-微乳薄层色谱斑点清晰,分离度高,因此本研究采用聚酰胺-微乳薄层系统结合高效薄层色谱建立同时测定黑果腺肋花楸果实中C3G、金丝桃苷、绿原酸含量的方法,4批黑果腺肋花楸果粉中C3G、金丝桃苷、绿原酸含量分别在2.028~3.886,0.092~0.155和0.653~1.058 mg/g,该方法样品制备简单,对所得数据进行统计分析,证明该方法重复性好、选择性强,可作为一个简单、快速的半定量方法。
UV-Vis法测定了黑果腺肋花楸果对DPPH自由基的清除率,当黑果腺肋花楸果冻干粉经超声醇提,按干重计算质量浓度约为0.18 mg/mL时可清除50%DPPH自由基,当提取物质量浓度达到1.2 mg/mL时,清除率可达95.90%,文献中报道的树莓醇提物、黑果小檗提取物、黑果枸杞水提物的IC50分别约为1.00、0.26、0.42 mg/mL[16-18],桑葚、蓝莓、黑加仑IC50分别约为0.95、8.91、8.11 mg/mL[19],作为新食品原料,对于浆果类来说黑果腺肋花楸果对DPPH自由基清除能力强。经薄层生物自显影技术初步确定黑果腺肋花楸果实中C3A、C3G、金丝桃苷、绿原酸、新绿原酸均具抗氧化活性,除此之外还存在其他未知抗氧化活性成分,有待于进一步分离鉴定。
值得注意的是黑果腺肋花楸果中含有新绿原酸,从薄层色谱图中看到新绿原酸斑点颜色较深,与绿原酸斑点颜色相近,新绿原酸与绿原酸是同分异构体,认为对仪器响应值一致,因此认为含量水平相当。新绿原酸除具有抗炎、抗氧化、抗癌[20-22]等活性外,还对醛糖还原酶[23],流感病毒神经氨酸酶[24]等具抑制作用,可用于糖尿病慢性并发症以及流感等疾病的防治。
本研究采用黑果腺肋花楸果冻干粉,真实反映了鲜果中的活性成分,鉴于黑果腺肋花楸果具较好的生物活性,除了在生态方面,其在饮料、食品、药品、医疗保健品等方面都具有较大的开发潜力和应用价值。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



