柚皮苷-壳寡糖复合物的制备及其抗氧化和抑菌活性研究
柑橘是世界上第一大宗水果,其品种主要有甜橙、宽皮柑橘、柚、柠檬和杂柑等[1]。柑橘果皮作为柑橘鲜食和加工的主要副产物,富含类黄酮、香豆素、膳食纤维等多种活性物质[2]。其中柚皮苷是柑橘果皮中最为常见的黄酮类物质之一[3]。柚皮苷是由4′,5,7-三羟基二氢黄酮苷元与鼠李糖苷[2-O-(6-脱氧-α-L-甘露聚糖)-β-D-葡萄糖]构成的化合物[4](图1-a),具有抗癌[5]、抗氧化[6]、抗炎[7]、降低胆固醇[8]等多种生物药理活性,具有作为人类膳食补充剂和畜禽天然抗生素的潜力。
目前,已有较为成熟的技术将柑橘皮渣中的柚皮苷提取并纯化,但由于其溶解度较低,味道偏苦,很少被直接使用,因此提高柚皮苷的溶解度,增加其生物利用度显得尤为重要。研究表明将活性成分与环糊精、环果糖、壳寡糖、磷脂等配体分子间通过共价键或氢键结合,可改善天然产物的溶解性[9]。壳寡糖是由2~20个氨基葡萄糖通过β-1,4糖苷键连接而成的糖链(图1-b),具有良好的生物降解、抗氧化和抑菌活性[10-11]。研究报道壳寡糖的分子质量是影响其功能性质的主要因素[12],分子质量<1 000 Da和>3 000 Da的壳寡糖功能活性存在很大差异[13]。CAO等[14]采用喷雾干燥和冷冻干燥的方法制备芦丁-壳寡糖复合物,发现其能增加芦丁的溶解性和抗氧化活性。WANG等[15]采用低分子质量壳寡糖制备三苯基膦-壳寡糖-姜黄素偶联物,发现其能去除急性肝损伤期间产生的过多活性氧,减轻氧化应激损伤。BI等[16]采用平均分子质量为1 500的壳寡糖制备壳寡糖香叶醇衍生物,结果表明其有良好的水溶性,可抑制大肠杆菌和金黄色葡萄球菌的生长,可作为新型抑菌剂用于食品防腐。目前关于柚皮苷与壳寡糖复合物的制备及其功能活性的探究鲜有报道。
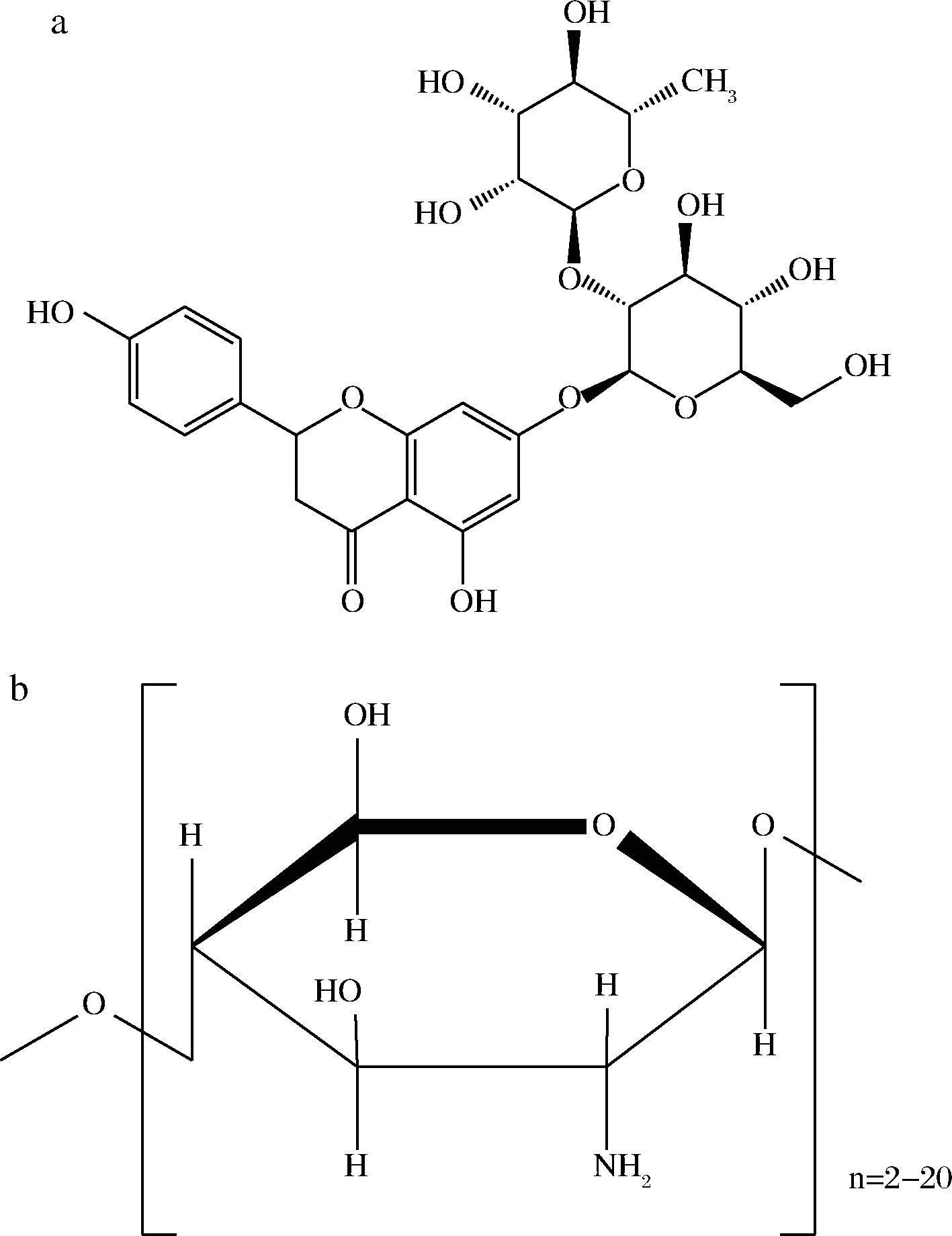
a-柚皮苷;b-壳寡糖
图1 柚皮苷和壳寡糖的分子结构
Fig.1 Molecular structure of naringin and oligochitosan
为了提高柚皮苷原有功能活性,增加其溶解度和生物利用度。本文以柚皮苷和壳寡糖为原料,按一定比例分别制备柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物,分析比较两类(共计10种)复合物与柚皮苷的溶解度、抗氧化和抑菌活性,确定适宜壳寡糖分子质量和混合比例。以期为柚皮苷在医疗保健、膳食补充和畜禽饲料方面的研究开发提供实验数据,也为柑橘果皮的综合利用提供理论参考。
1 材料与方法
1.1 材料与试剂
柚皮苷、邻菲罗啉、壳寡糖A(分子质量2 000~3 000 Da)、壳寡糖B(分子质量800~1 000 Da)(纯度>97%),上海源叶生物科技有限公司;DPPH、FeSO4、磷酸盐缓冲液(pH 7.4),重庆市北碚区旭科化学试剂经营部;大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、鼠伤寒沙门氏菌(Salmonella typhimurium),重庆市宝欣泰生物科技有限公司。
1.2 仪器与设备
Ultimate3000高效液相色谱仪,美国戴安公司;BRUKER TENSOR 27傅里叶变换红外光谱仪,德国布鲁克;Phenom Pro扫描电镜,荷兰飞纳;X′Pert3 Powder X射线衍射仪,荷兰帕纳特;TU-1901双光束紫外可见分光光度计,北京普析通用仪器有限责任公司;3020-352酶标仪,赛默飞;HZQ-F160全温振荡培养箱,苏州市培英实验设备有限公司。
1.3 实验方法
1.3.1 柚皮苷-壳寡糖复合物的制备
称取柚皮苷2.32 g,壳寡糖A 6 g,分别溶于适量95%乙醇中,将两者等量混合,涡旋振荡5 min。复合物在45 ℃下旋转蒸发除去大部分溶剂,于60 ℃真空干燥,粉碎过筛[17]即得柚皮苷与壳寡糖A物质的量比为2∶1的柚皮苷-壳寡糖复合物A。按上述方法分别制得物质的量比为1∶1、1∶2、1∶3和1∶5的柚皮苷-壳寡糖复合物B、C、D、E。同时制备柚皮苷与壳寡糖B的复合物a、b、c、d、e。
1.3.2 扫描电镜分析
在铜板上黏贴导电胶,取适量60 ℃真空干燥样品于导电胶上喷金处理后,在300倍率的条件下用场发射扫描电子显微镜观察柚皮苷、壳寡糖A、壳寡糖B和复合物晶体形态,确定是否形成复合物。
1.3.3 傅里叶变换红外光谱分析
取适量柚皮苷、壳寡糖A、壳寡糖B、柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物与KBr以质量比1∶200混合压片,将压片好的样品于傅里叶红外光谱仪上进行500~4 500 cm-1的检测。
1.3.4 X射线衍射分析
将样品均匀铺放X射线衍射仪衍射槽内,在扫描范围2θ=5~60°,步长0.02°,电流40 mA,电压40 kV的条件下测定样品结晶度。
1.3.5 溶解度的测定
将柚皮苷分别与壳寡糖A、壳寡糖B按物质的量1∶1混合制成物理混合物,分别将过量样品和混合物溶于超纯水中,涡旋振荡5 min,37 ℃下振荡溶解24 h后于4 000 r/min离心10 min,取1 mL上清液过0.45 μm微孔滤膜进行HPLC分析。溶解量为测得柚皮苷含量与溶液应有柚皮苷含量比。
检测条件:Venusil MPC18色谱柱(4.6 mm×250 mm,5 μm);柱温30 ℃;检测波长283 nm;检测器:紫外检测器;流动相1%冰乙酸(A)~甲醇(B);进样量10 μL;流速1 mL/min。
1.3.6 抗氧化活性分析
将柚皮苷、壳寡糖A、壳寡糖B、柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物溶于蒸馏水中,制成1.0 g/L的样品溶液,参考XU等[18]的方法对样品DPPH自由基、·OH和ABTS阳离子自由基清除活性进行测定,并用1.0 g/L 抗坏血酸溶液作阳性对照。
1.3.7 抑菌活性分析
1.3.7.1 实验菌液制备
抑菌实验参考李莉等[19]的方法,将金黄色葡萄球菌、大肠杆菌和鼠伤寒沙门氏菌于琼脂平板培养基37 ℃培养24 h活化后,培养稀释至106 CFU/mL的菌液作为实验菌液。
1.3.7.2 样品抑菌液配制
将柚皮苷、壳寡糖A、壳寡糖B、柚皮苷-壳寡糖A复合物、柚皮苷-壳寡糖B复合物和土霉素用无菌水倍比稀释,配制质量浓度为320、160、80、40、20、10、5、2.5 mg/mL的抑菌液。
1.3.7.3 无菌滤纸片的制备
将滤纸制成直径为6 mm的纸片,121 ℃高压灭菌15 min后,分别浸泡于20 mg/mL柚皮苷、复合物及土霉素溶液中12 h备用。
1.3.7.4 体外抑菌实验
取1.3.7.1制备好的实验菌液50 μL均匀涂布在琼脂平板上,将浸泡后的滤纸片铺于琼脂平板上,每个平板4片,做好标记,间距均匀。用土霉素溶液作为阳性对照,普通滤纸片为阴性对照,37 ℃培养24 h后,用游标卡尺测量抑菌圈大小。
1.3.7.5 最低抑菌浓度(minimum inhibitory concentration,MIC)实验
在96孔板上设置实验孔为50 μL培养基+10 μL实验菌液+60 μL不同浓度样品抑菌液;阳性对照孔为50 μL培养基+10 μL实验菌液+60 μL不同浓度土霉素溶液;阴性对照孔为110 μL培养基+10 μL实验菌液;培养基对照孔为120 μL培养基;抑菌液对照孔为120 μL不同浓度样品抑菌液;空白对照孔为60 μL培养基+60 μL不同浓度样品抑菌液。每组平行4个孔取平均值。用酶标仪在630 nm处测定各孔吸光度值,并结合肉眼观察确定各抑菌液最低抑菌浓度。
1.3.7.6 最低杀菌浓度(minimum bactericidal concentration,MBC)实验
根据MIC实验结果,取未见细菌生长的各孔培养液各50 μL,涂布于琼脂平板,37 ℃培养24 h后,观察有无菌落长出,平板上菌落数少于5个的最小稀释度的抑菌液浓度为最低杀菌浓度。
1.3.8 数据分析处理
实验数据采用Origin 2018和ChemDraw17.0处理作图;采用Excel 2019和SPSS 26.0对抗氧化和抑菌能力进行数据处理,ANOVA进行Duncan差异分析;所有样品平行实验3次,结果为平均值±标准差。
2 结果与讨论
2.1 扫描电镜分析
将复合物通过喷金处理后,在场发射扫描电子显微镜下观察其形态。由图2可知,柚皮苷颗粒呈棒状结晶,而壳寡糖颗粒均呈空心的球状结构,且壳寡糖A晶体较壳寡糖B晶体大。柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物呈不规则多面体结构,且柚皮苷-壳寡糖A复合物晶体较柚皮苷-壳寡糖B复合物晶体大,两者相比柚皮苷和壳寡糖晶体形态发生了明显变化,且未在复合物扫描电镜图中发现柚皮苷或壳寡糖的晶体。

图2 柚皮苷、壳寡糖及其复合物扫描电镜图
Fig.2 Scanning electron micrographs of naringin, chitooligosaccharide and its complexes 注:a-柚皮苷;b-壳寡糖A;c-壳寡糖B;d、e、f、g、h为复合物A、B、C、D、E;i、j、k、l、m为复合物a、b、c、d、e(图3同)
此外,柚皮苷晶体原有的颜色为淡黄色,而复合物晶体颜色为均匀的深棕色或深褐色(图3)。以上结果表明,柚皮苷与壳寡糖在乙醇溶剂中相互结合反应形成了新的复合物。

图3 柚皮苷、壳寡糖及其复合物图片
Fig.3 Pictures of naringin, chitooligosaccharide and its complexes
2.2 傅里叶红外光谱分析
红外光谱能提供化合物官能团的相关信息[20]。将柚皮苷、壳寡糖及复合物经压片处理后,在500~4 500 cm-1波数进行扫描。所得红外光谱如图4和图5所示,对于柚皮苷的光谱,在光谱学中3 378.43 cm-1处吸收峰是通过氢键结合形成的—OH的伸缩振动带,在2 920.86 cm-1处吸收峰是—CH的伸缩振动带,在1 645.63 cm-1处的吸收峰为—C![]() O的伸缩振动带[21]。在1 518.75、1 298.85、1 135.48、1 075.46、1 041.77 cm-1处为苯环的特征吸收峰[22]。而壳寡糖的光谱图在3 412 cm-1处为—OH的拉伸振动,2 935 cm-1处为—CH的拉伸振动,1 638 cm-1为—NH的拉伸振动,1 074 cm-1为—C—N的拉伸振动[23]。柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物的吸收光谱为柚皮苷和壳寡糖光谱的重叠,在3 420 cm-1处均有强的—OH伸缩振动峰。其中柚皮苷-壳寡糖A复合物在2 920.86 cm-1处的—CH吸收峰移至2 986 cm-1左右,柚皮苷-壳寡糖B复合物则移至2 978 cm-1左右;柚皮苷-壳寡糖A复合物1 645.63 cm-1处的—C
O的伸缩振动带[21]。在1 518.75、1 298.85、1 135.48、1 075.46、1 041.77 cm-1处为苯环的特征吸收峰[22]。而壳寡糖的光谱图在3 412 cm-1处为—OH的拉伸振动,2 935 cm-1处为—CH的拉伸振动,1 638 cm-1为—NH的拉伸振动,1 074 cm-1为—C—N的拉伸振动[23]。柚皮苷-壳寡糖A复合物和柚皮苷-壳寡糖B复合物的吸收光谱为柚皮苷和壳寡糖光谱的重叠,在3 420 cm-1处均有强的—OH伸缩振动峰。其中柚皮苷-壳寡糖A复合物在2 920.86 cm-1处的—CH吸收峰移至2 986 cm-1左右,柚皮苷-壳寡糖B复合物则移至2 978 cm-1左右;柚皮苷-壳寡糖A复合物1 645.63 cm-1处的—C![]() O吸收峰移至1 640 cm-1左右,柚皮苷-壳寡糖B复合物则移至1 642 cm-1左右;柚皮苷-壳寡糖A复合物苯环的特征吸收峰移至1 524、1 157、1 071 cm-1,柚皮苷-壳寡糖B复合物苯环的特征吸收峰移至1 566、1 409、1 074 cm-1,且苯环的特征吸收峰减少。综上,柚皮苷-壳寡糖A复合物与柚皮苷-壳寡糖B复合物对应比例复合物的红外光谱图基本重合,说明柚皮苷与壳寡糖A、壳寡糖B是通过相同的方式形成复合物。柚皮苷与壳寡糖两者分子间发生了相互作用,其结合位点可能位于苯环和羟基,使其在1 000~1 600和3 340 cm-1的吸收峰与柚皮苷的吸收峰不同。
O吸收峰移至1 640 cm-1左右,柚皮苷-壳寡糖B复合物则移至1 642 cm-1左右;柚皮苷-壳寡糖A复合物苯环的特征吸收峰移至1 524、1 157、1 071 cm-1,柚皮苷-壳寡糖B复合物苯环的特征吸收峰移至1 566、1 409、1 074 cm-1,且苯环的特征吸收峰减少。综上,柚皮苷-壳寡糖A复合物与柚皮苷-壳寡糖B复合物对应比例复合物的红外光谱图基本重合,说明柚皮苷与壳寡糖A、壳寡糖B是通过相同的方式形成复合物。柚皮苷与壳寡糖两者分子间发生了相互作用,其结合位点可能位于苯环和羟基,使其在1 000~1 600和3 340 cm-1的吸收峰与柚皮苷的吸收峰不同。
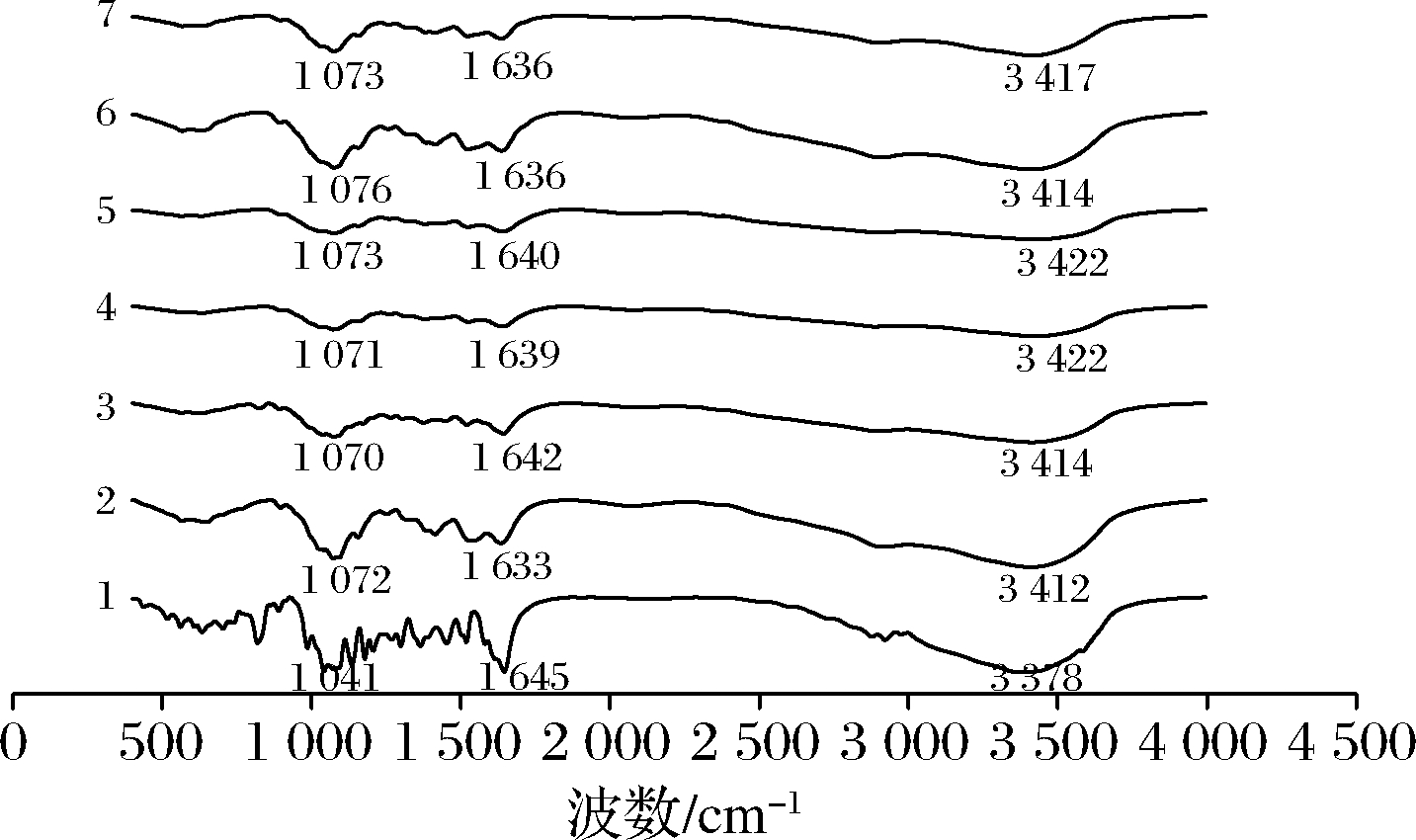
1-柚皮苷;2-壳寡糖A;3~7-复合物A~E
图4 柚皮苷-壳寡糖A复合物傅里叶红外光谱分析图
Fig.4 Fourier infrared spectroscopic analysis of naringin-chitooligosaccharide A complex

1-柚皮苷;2-壳寡糖B;3~7-复合物a~e
图5 柚皮苷-壳寡糖B复合物傅里叶红外光谱分析图
Fig.5 Fourier infrared spectroscopic analysis of naringin-chitooligosaccharide B complex
2.3 X射线衍射分析
X射线衍射是分析材料晶体结构或形态的常用技术[24],将复合物置于衍射槽内,在2θ=5~60°扫描,其扫描结果见图6、图7,柚皮苷在2θ为5~30°时具有一系列尖锐、强烈的特征衍射峰,符合其晶体特性[25]。2种分子质量的壳寡糖均无尖锐的特征峰,衍射图谱呈现宽峰,证明了壳寡糖非晶体的性质。在柚皮苷-壳寡糖A复合物中,复合物A在2θ为9.19、9.87、15.12、15.68、25.46°有尖锐的特征峰,与柚皮苷相对比其大多数特征峰消失。同理,在柚皮苷-壳寡糖B复合物中,复合物a在2θ为9.25、9.91、15.16、15.71、20.08、21.08、25.48°有尖锐的特征峰,复合物b在2θ为15.16、15.75°有尖锐的特征峰。此外,其余复合物(复合物B、复合物C、复合物D、复合物E、复合物c、复合物d、复合物e)的衍射图谱和壳寡糖相似,且柚皮苷的特征峰几乎全部消失,表明柚皮苷分散于壳寡糖分子中,结晶度降低或消失[26]。
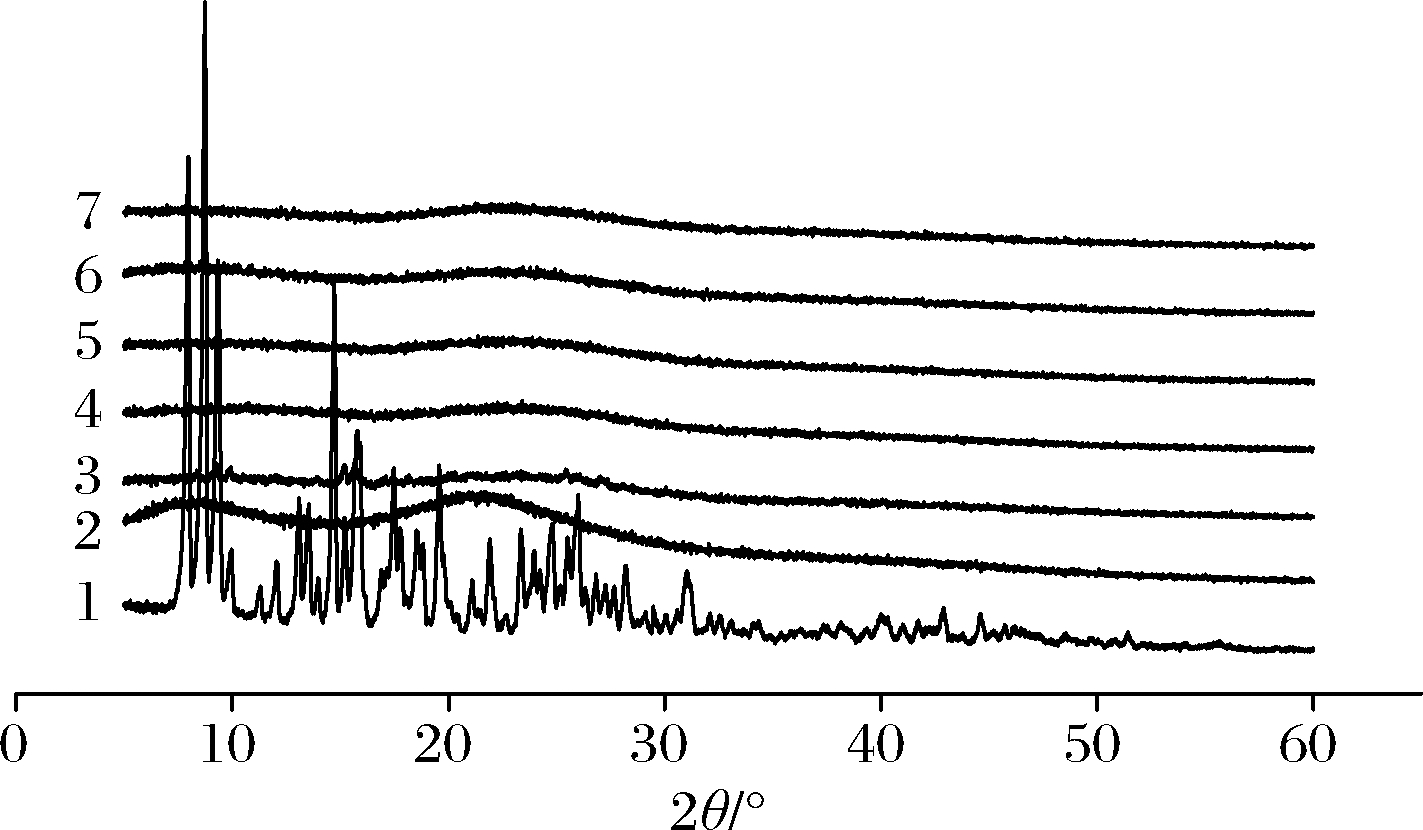
1-柚皮苷;2-壳寡糖A;3~7-复合物A~E
图6 柚皮苷-壳寡糖A复合物X射线衍射图谱
Fig.6 X-ray diffraction pattern of naringin- chitooligosaccharide A complex
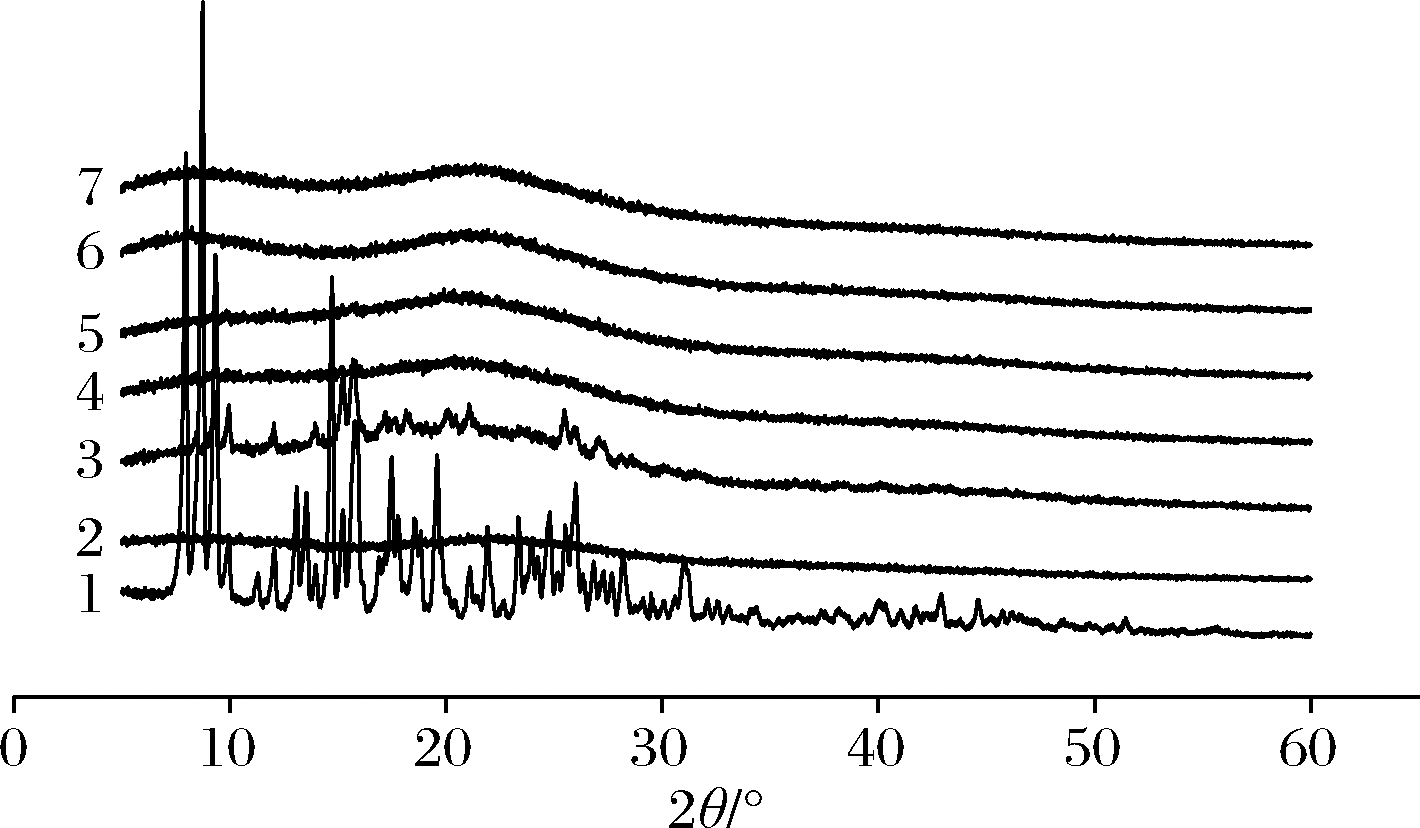
1-柚皮苷;2-壳寡糖B;3~7-复合物a~e
图7 柚皮苷-壳寡糖B复合物X射线衍射图谱
Fig.7 X-ray diffraction pattern of naringin- chitooligosaccharide B complex
2.4 不同比例复合物的溶解度比较
取复合物溶解,经振摇24 h后发现柚皮苷-壳寡糖B复合物的溶解性较差,有沉淀沉于底部。柚皮苷-壳寡糖A复合物的溶解性较好,基本全部溶解。采用HPLC对柚皮苷具体溶解性进行分析,利用柚皮苷标准品进行外标法定量分析,得到柚皮苷标准品的标准曲线方程为Y=23.651X-5.301(R2=0.999)。根据复合物中柚皮苷含量与高效液相色谱测得的柚皮苷含量计算柚皮苷溶解度。由图8可得,在复合物中,物质的量比为2∶1、1∶1、1∶2、1∶3、1∶5的柚皮苷-壳寡糖A复合物中柚皮苷的溶解度分别为柚皮苷的36.4、14.9、56.2、85.5、80.9倍。而物质的量比为2∶1、1∶1、1∶2、1∶3、1∶5的柚皮苷-壳寡糖B复合物中柚皮苷的溶解度是柚皮苷的9.8、15.9、18.1、48.9、53.3倍。相比于柚皮苷,复合物中柚皮苷的溶解度显著增加,且柚皮苷-壳寡糖A复合物中柚皮苷的溶解度优于柚皮苷-壳寡糖B。此外,复合物中柚皮苷的溶解度随壳寡糖比例的增加而上升,这可能是由于壳寡糖打乱柚皮苷的原有结晶,使其结晶度降低从而提高其溶解度[27]。
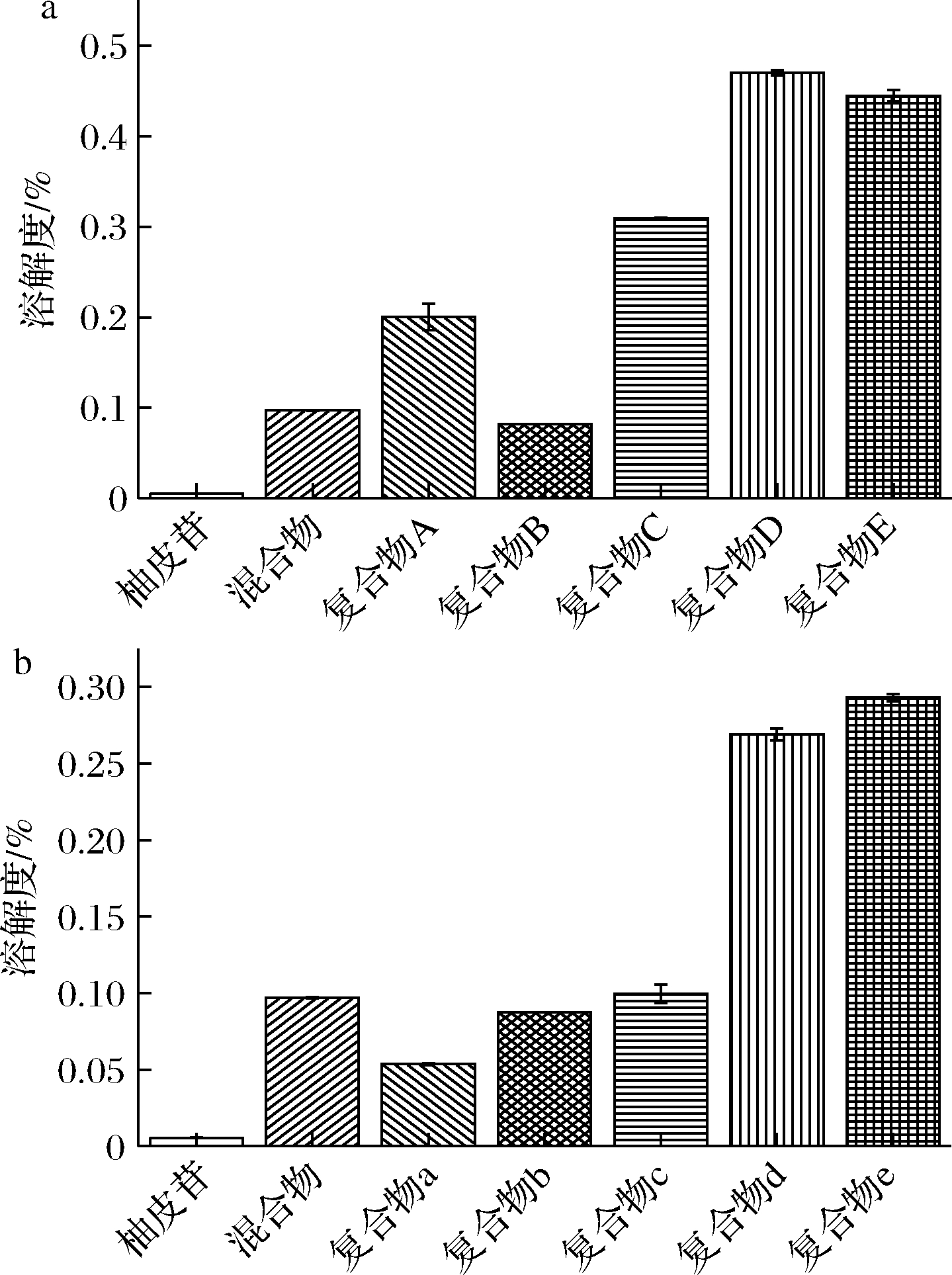
图8 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 在水中的溶解度
Fig.8 Solubility of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes in water
2.5 抗氧化分析
通过分光光度计测定复合物对DPPH自由基、·OH和ABTS阳离子自由基的清除率。由图9-a、图9-b可得,柚皮苷-壳寡糖A复合物对DPPH自由基的清除率(59.52%~74.34%)和柚皮苷-壳寡糖B复合物对DPPH自由基的清除率(57.66%~86.97%)相对于柚皮苷对DPPH自由基的清除率20.13%显著提高。由图9-c、图9-d可得,除复合物a外柚皮苷-壳寡糖A复合物对·OH的清除率(16.87%~50.42%)和柚皮苷-壳寡糖B复合物对·OH的清除率(10.81%~42.23%)与柚皮苷对·OH的清除率(13.70%)相比,均有所增加。由图9-e、图9-f可得,除复合物D和复合物E外柚皮苷-壳寡糖A复合物对ABTS阳离子自由基的清除率(10.33%~19.68%)和柚皮苷-壳寡糖B复合物对ABTS阳离子自由基的清除率(13.22%~20.70%)与柚皮苷对ABTS阳离子自由基的清除率(12.78%)相比,均有所增加,但增加的程度较DPPH自由基和·OH低。对DPPH自由基、·OH和ABTS阳离子自由基的清除率大小为:复合物A>复合物B>复合物C>复合物D>复合物E,复合物e>复合物d>复合物c>复合物b>复合物a。虽然壳寡糖A的抗氧化活性低于壳寡糖B,但就整体而言柚皮苷-壳寡糖A复合物、柚皮苷-壳寡糖B复合物的抗氧化活性相差不大,且相比于单一柚皮苷均有所提高。已有研究表明,类黄酮的抗氧化活性与其分子中羟基的个数和位置有关[28],引入壳寡糖分子中羟基从而提高了复合物抗氧化能力[29]。
2.6 抑菌活性分析
通过制备复合物药敏纸片,测定复合物对3种常见致病菌的抑菌效果。抑菌圈实验结果如表1所示,阴性对照为药敏纸片直径,柚皮苷-壳寡糖A复合物对大肠杆菌抑制作用明显,鼠伤寒沙门氏菌次之,对金黄色葡萄球菌抑制作用较小。在柚皮苷-壳寡糖A复合物中,复合物E抑菌效果最为明显;在柚皮苷-壳寡糖B复合物中,复合物d抑菌效果最为明显。总体而言,复合物增加了柚皮苷对大肠杆菌和金黄色葡萄球菌的抑菌效果。复合物抑菌效果的增加可能是由于其能与细菌相互作用,破坏其细胞膜,使胞内成分释放[26, 29]。柚皮苷-壳寡糖A复合物对大肠杆菌的抑制效果更明显;柚皮苷-壳寡糖B对金黄色葡萄球菌的抑菌效果更明显,两类复合物对沙门氏菌的抑菌效果相当。柚皮苷对沙门氏菌的抑菌效果明显,复合物多数未能增加其对沙门氏菌的抑菌效果。

a、b-DPPH自由基清除率;c、d-·OH清除率;e、f-ABTS阳离子自由基清除率
图9 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物的抗氧化活性
Fig.9 Antioxidant activity of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes
表1 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 对3种致病菌抑菌活性 单位:%
Table 1 Antibacterial activities of naringin- chitooligosaccharide A and naringin-chitooligosaccharide B complexes on three pathogens
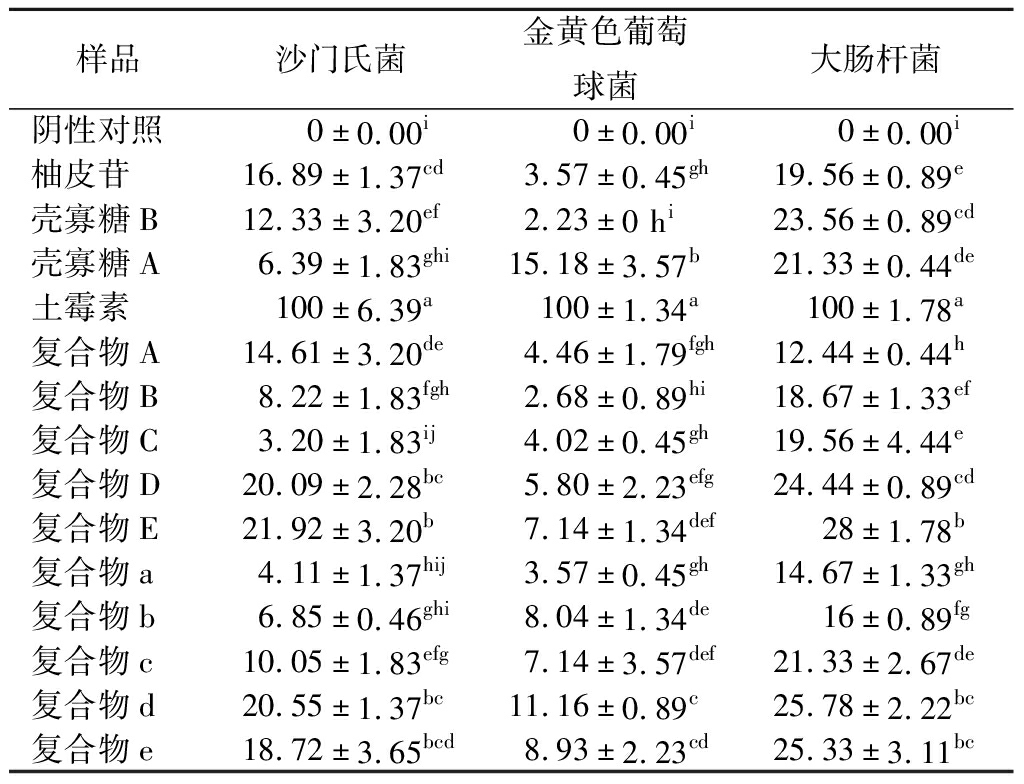
注:同行标注不同小写字母表示差异显著(P<0.05)
培养24 h后观察各孔澄清度,若肉眼可见浑浊,且有白色沉淀,则表明有细菌大量生长,抑菌效果较差。结果如表2所示,培养基对照孔和土霉素对照孔均保持原有颜色,澄清无菌落生长。当药物质量浓度达5 mg/mL时,复合物C、复合物E、复合物c、复合物d对鼠伤寒沙门氏菌有明显抑制作用,当药物质量浓度达10 mg/mL时,除复合物b外均对鼠伤寒沙门氏菌有明显抑制作用。复合物b在药物质量浓度达20 mg/mL时对鼠伤寒沙门氏菌有明显抑制作用。
表2 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 对鼠伤寒沙门氏菌抑制效果
Table 2 Inhibitory effect of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes on Salmonella typhimurium
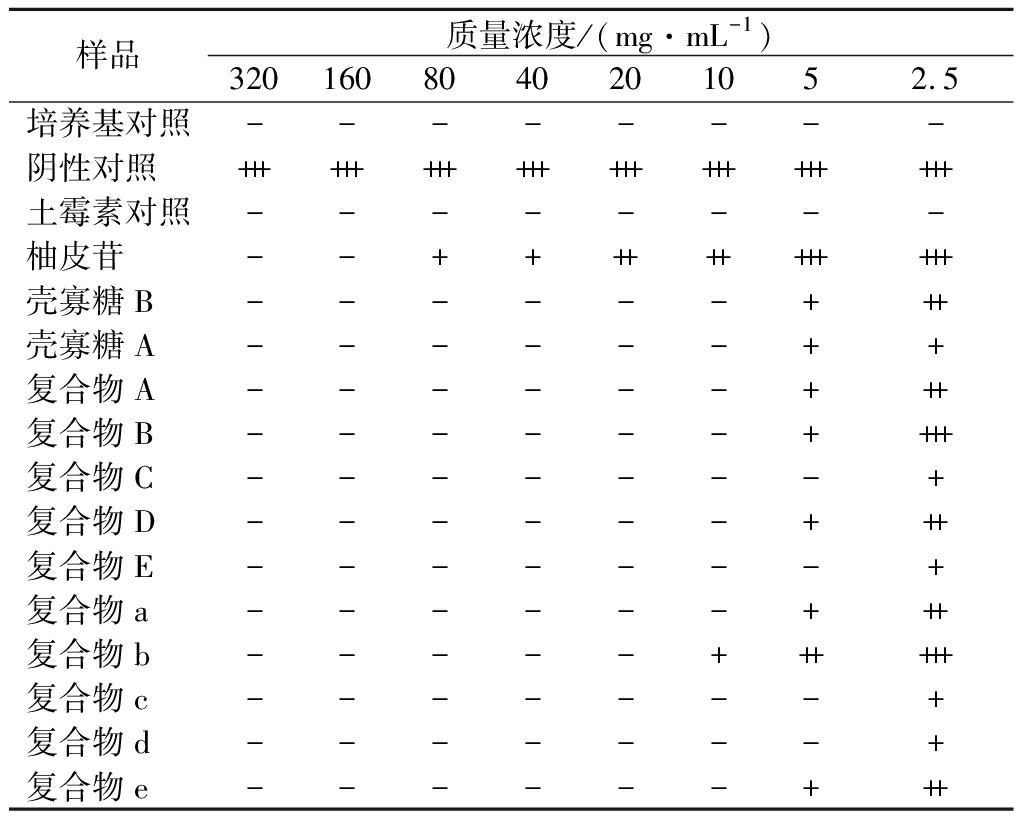
注:表中“-”为澄清无菌落生长;“+”为有菌落生长,培养基稍显浑浊;“++”为有菌落生长,培养基中度浑浊,无白色沉淀;“+++”为有菌落生长,培养基浑浊,有白色沉淀(下同)
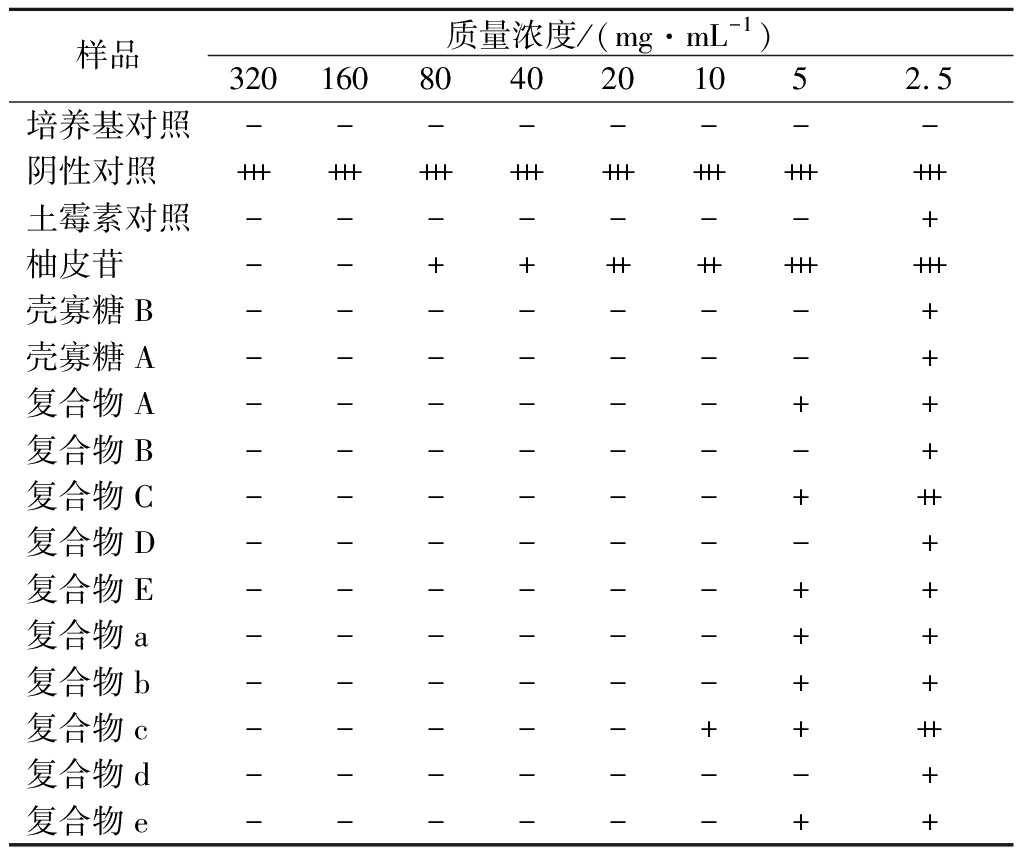
复合物对金黄色葡萄球菌的抑制效果如表3所示,当药物质量浓度达5 mg/mL时,复合物B、复合物D、复合物d对金黄色葡萄球菌有明显抑制作用,当药物质量浓度达10 mg/mL时,除复合物c外其余复合物均对金黄色葡萄球菌有明显抑制作用,当药物质量浓度达20 mg/mL时,复合物c对金黄色葡萄球菌有明显抑制作用。
表3 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 对金黄色葡萄球菌抑制效果
Table 3 Inhibitory effect of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes on Staphylococcus aureus
复合物对大肠杆菌的抑制效果如表4所示,当药物质量浓度为5 mg/mL时,复合物D、复合物E对大肠杆菌有明显抑制作用,当药物质量浓度达10 mg/mL时,复合物A、复合物d、复合物e对大肠杆菌有明显抑制作用,当药物质量浓度达20 mg/mL时,复合物a对大肠杆菌菌有明显抑制作用。当药物质量浓度达40 mg/mL时,复合物B、复合物C、复合物b、复合物c对大肠杆菌有明显抑制作用。
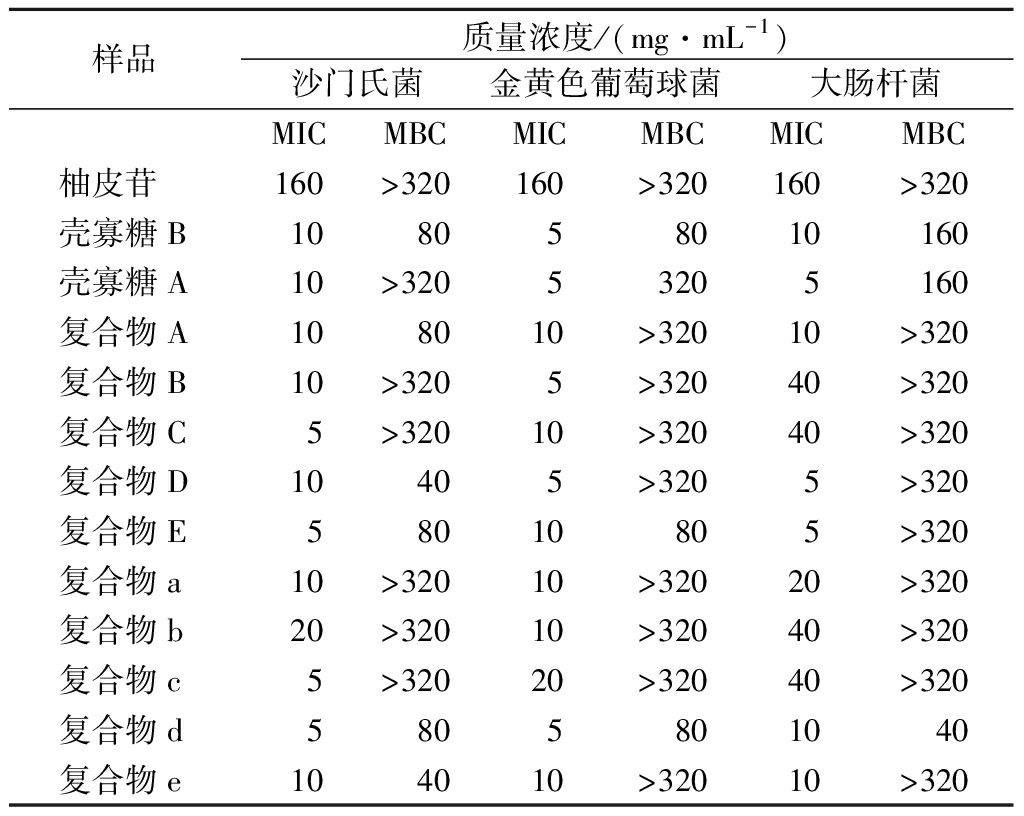
根据上述肉眼观察并结合吸光度值测定结果,测定10种复合物对3种常见致病菌的MIC和MBC结果如表5所示,结合进一步培养观察,测得复合物d对大肠杆菌的MBC为40 mg/mL,复合物E及复合物d对金黄色葡萄球菌的MBC为80 mg/mL,复合物D和复合物e对鼠伤寒沙门氏菌的MBC为40 mg/mL,复合物A、复合物E、复合物d对鼠伤寒沙门氏菌的MBC为80 mg/mL。由于药物浓度限制,其余复合物对致病菌的MBC并未测出。复合物A、复合物B、复合物C、复合物a、复合物b、复合物c的杀菌作用较弱。柚皮苷在质量浓度160 mg/mL时对3种致病菌具有明显的抑制作用,在320 mg/mL质量浓度范围内,未测得其MBC。推测可能是由于壳寡糖比例的增加,增加了复合物的杀菌效果,使复合物MBC较柚皮苷有所下降。
表4 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 对大肠杆菌抑制效果
Table 4 Inhibitory effect of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes on Escherichia coli
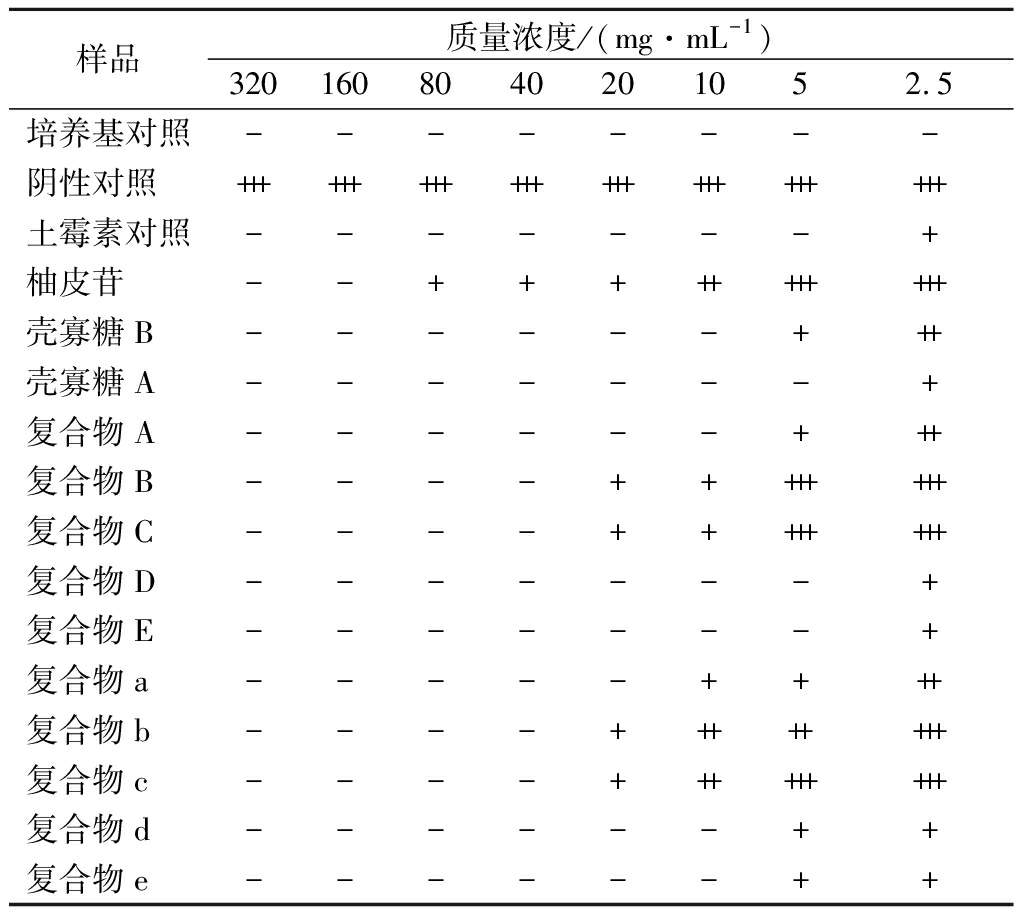
表5 柚皮苷-壳寡糖A、柚皮苷-壳寡糖B复合物 对3种致病菌的MIC及MBC
Table 5 MIC and MBC of naringin-chitooligosaccharide A and naringin-chitooligosaccharide B complexes against three pathogens
3 结论
本实验选用壳寡糖A(分子质量2 000~3 000 Da)和壳寡糖B(分子质量800~1 000 Da),制备不同比例的柚皮苷-壳寡糖复合物,通过扫描电镜、红外光谱和X射线衍射分析比较柚皮苷、柚皮苷-壳寡糖A和柚皮苷-壳寡糖B复合物的结构特征和溶解度,并分析比较其抗氧化、抑菌活性。柚皮苷与两类壳寡糖通过氢键或范德华力等非共价键形成稳定复合物。经过HPLC分析复合物的水溶性,柚皮苷-壳寡糖复合物在原有柚皮苷的溶解度上提高约54.8倍。复合物比柚皮苷具有更好的抗氧化活性。复合物对自由基的清除率强弱为DPPH自由基>·OH>ABTS阳离子自由基。其中复合物A和复合物e的抗氧化活性最高。此外,复合物也增加了柚皮苷对大肠杆菌、金黄色葡萄球菌和鼠伤寒沙门氏菌的抑制效果,且复合物D、复合物E、复合物d和复合物e对致病菌有一定的杀菌效果,是潜在的抑菌剂。综上,柚皮苷与壳寡糖A在比例为2∶1时形成的复合物,抗氧化活性最佳;在比例1∶3和1∶5时形成的复合物,柚皮苷溶出率和抑菌活性最佳。柚皮苷与壳寡糖B在比例1∶3和1∶5时形成的复合物,其柚皮苷溶出率、抗氧化和抑菌活性均最佳。该研究为柚皮苷在畜禽饲料领域、生物医疗领域和功能保健食品等领域的开发应用提供新思路。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



