桑葚酵素发酵过程中活性物质与抗氧化能力的相关性研究
桑葚作为药食同源的水果,富含维生素、蛋白质、微量元素及多种功能活性物质[1]。桑葚功能性虽强,但果品运输、贮藏中耗损大,除鲜食外,少部分被精深加工为果汁、果酒等,产品线单一[2]。酵素作为新兴产品,有机酸、氨基酸、维生素等营养物质含量丰富,且发酵赋予了产品良好的口感和风味,其清洁肠道、解酒护肝、抗氧化等功效深受消费者喜爱[3]。
酵素制作工艺多采用自然发酵,为混菌发酵体系,其微生物组成和代谢过程复杂,品质和风味优于接种发酵[4]。由于环境微生物的复杂性,导致酵素发酵机理不明确,产品品质不稳定,不适合现代化工业生产。因此,对酵素自然发酵过程的理化和功能成分进行监测和分析,有助于探究酵素的自然发酵机理。
本研究以自然发酵桑葚酵素为实验对象,检测传统酵素发酵过程中主要活性成分的变化,了解酵素功能活性物质的代谢规律,并分析各活性成分对产品抗氧化性产生的影响,旨在进一步认识桑葚酵素的抗氧化机制,为改善自然发酵酵素工艺、减少损耗,及标准化、工业化生产桑葚酵素提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
桑葚(购于宜宾农贸市场);白砂糖,市售一级;DPPH、ABTS,美国Sigma公司;福林酚、没食子酸、芦丁(AR级),麦克林生化科技有限公司;有机酸标准品(草酸、酒石酸、苹果酸、乳酸、柠檬酸、琥珀酸、丙酮酸、乙酸,HPLC级,纯度≥99%),上海源叶生物技术有限公司。
1.2 仪器设备
T6新世纪紫外可见分光光度计,北京普析通用仪器有限责任公司;1260 infinityⅡ高效液相色谱仪,美国Agilent公司;HWS-12恒温水浴锅,上海乔欣科学仪器有限公司;0.22 μm水系滤膜,天津市津腾实验设备有限公司;AR1140电子天平,奥豪斯国际贸易有限公司。
1.3 方法
1.3.1 桑葚酵素的制备
桑葚用无菌水冲洗后,自然晾干,白砂糖用紫外照射45 min,玻璃发酵罐高压蒸汽灭菌。将桑葚与糖按质量比2∶1的比例混合,放入发酵罐中,密封后28 ℃避光发酵80 d。分别于发酵0、5、10、15、20、25、30、40、50、60、80 d取样,1 000 r/min离心10 min后,取上层发酵液置于-80 ℃冰箱中保存,待测。
1.3.2 桑葚酵素理化指标的测定
采用pH计测定pH值;还原糖含量的测定采用DNS法[5];总酸含量的测定参照GB 12456-2021《食品中总酸的测定》中的pH计电位滴定法。
1.3.3 主要抗氧化成分测定
总酚的测定使用福林—酚比色法[6],按照标准曲线线性方程y=5.547x+0.002 2(R2=0.999 6) 计算总酚浓度,以没食子酸的质量计。总黄酮的测定采用NaNO2-Al(NO3)3比色法[7],按照标准曲线方程为y=0.001x+0.005 4(R2=0.999 3)计算总黄酮含量,以芸香甙的质量计。
1.3.4 体外抗氧化能力测定
DPPH自由基清除能力测定参照文献[8]的方法;·OH清除能力测定参照文献[9]的方法;ABTS阳离子自由基清除能力测定参照文献[10]的方法;还原力的测定参照文献[11]的方法。
1.3.5 有机酸含量测定
参照杨建飞等[12]的方法并加以改进。高效液相色谱条件:Agilent ZORBAX SB-Aq(4.6 mm×250 mm,5 μm)色谱柱,流动相A为KH2PO4溶液(pH=2.54),流动相B为甲醇溶液,V(KH2PO4)∶V(甲醇)=95∶5,进样量10 μL,VWD检测器,检测波长210 nm,流速0.4 mL/min,柱温30 ℃。
1.4 数据处理
采用SPSS 17.0进行皮尔逊相关性分析及主成分分析,采用SIMCA 14.1对主成分的分图进行绘制,采用Origin 2018、Excel绘制图表。
2 结果与讨论
2.1 发酵过程中理化指标的变化
桑葚酵素发酵过程中还原糖、pH和总酸的变化如图1所示。发酵的前30 d,还原糖总体呈不断下降的趋势,从初始的532.71 g/L下降到388.08 g/L。而总酸呈不断上升的趋势,从初始的4.55 g/L上升到28.69 g/L,证明发酵体系中的微生物利用糖生长代谢,并产生以乳酸、乙酸为主的大量有机酸,同时使pH从初始的4.58下降至3.16。30 d以后,还原糖、总酸基本趋于平稳,表明微生物代谢减弱,发酵进入后熟阶段。到发酵截止的80 d内,还原糖含量轻微浮动,可能是微生物分解利用桑葚原料中的糖类物质引起的[13]。发酵结束时,总酸含量为26.97 g/L,其下降的原因可能是发酵液中的有机酸被氧化分解、形成脂类、被菌群作为碳源消耗等。

a-还原糖含量;b-pH、总酸含量
图1 不同发酵时间还原糖、pH、总酸含量的变化
Fig.1 The change of reducing sugar content, pH and total acid content
2.2 发酵过程中主要抗氧化成分的变化
桑葚酵素发酵过程中总酚、总黄酮的测定结果如图2所示。在发酵5 d,总酚和总黄酮急剧上升,可能是由于原料处理时,加糖搅拌使原料发生氧化,密封发酵后,部分多酚物质的溶出导致的。5 d后总酚和总黄酮减少的原因可能是酚类化合物与固形物、蛋白质甚至酵母结合或吸附,导致了酚类化合物含量的下降[14]。
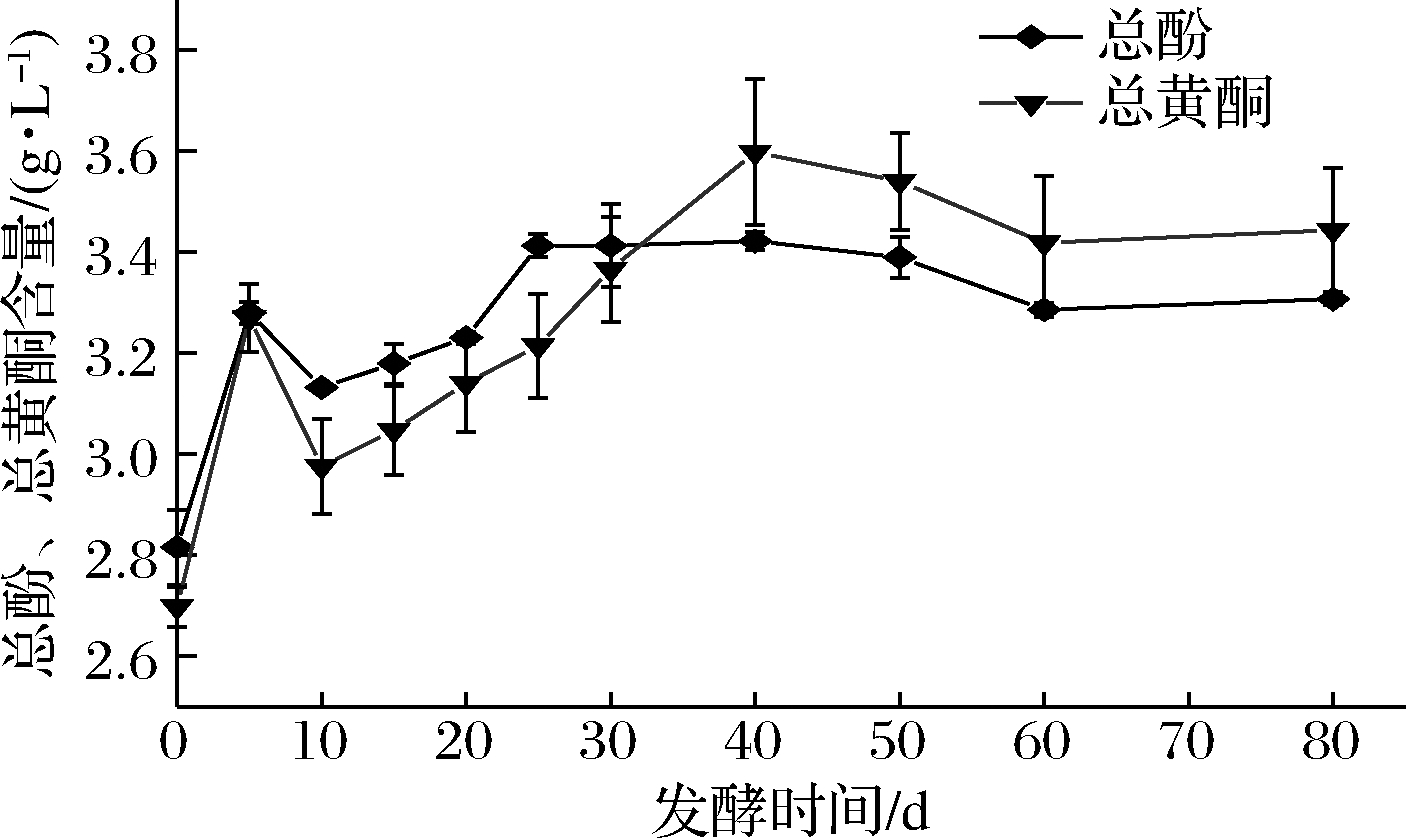
图2 桑葚酵素发酵过程中总酚、总黄酮含量的变化
Fig.2 Changes of total phenol and total flavone contents in mulberry fermentation
随着发酵的进行,某些大分子酚类物质逐渐被微生物分解为小分子酚类化合物,使总酚和总黄酮浓度不断增加[15],在发酵40 d时达到最大值,分别为3.42 g/L和3.60 g/L。40 d后,总酚和总黄酮开始呈下降趋势,可能是由于发酵时间过长,多酚类化合物发生非酶促反应,进一步聚合[16]。此结果与前人研究结果相似[17-18]。
2.3 发酵过程中体外抗氧化能力的变化
由图3-a所示,桑葚酵素DPPH自由基清除能力在发酵过程中缓慢上升,25 d时,从初始的64.59%上升至最大值71.16%,之后开始有轻微的上下浮动,发酵结束时DPPH自由基清除能力为69.37%。伟仕静等[19]研究发现,发酵过程中总酚的变化与其DPPH自由基清除能力之间有明显的相关性,与本实验结果相似。
由图3-b所示,桑葚酵素ABTS阳离子自由基清除能力25 d内从初始的59.31%迅速上升至73.41%,25 d后缓慢上升,于50 d时达到最大值74.04%,之后又略有下降,发酵结束时的清除能力为70.85%。桑葚酵素发酵过程中ABTS阳离子自由基清除能力的变化与总酚含量变化相似,HAGERMAN等[20]研究表明酚类化合物的聚合度、共轭度、酚类取代基的数量和排列以及分子质量在清除ABTS阳离子自由基上起着关键作用。
由图3-c所示,桑葚酵素·OH清除能力在发酵的前30 d明显增强,于第30天达到最大值39.83%,相较初始的·OH清除率19.28%,增长了106.58%。30 d后,桑葚酵素的·OH清除能力略有下降后趋于平稳。·OH清除率的变化可能是有机酸、酚类物质、酵母代谢产物综合作用的结果[21]。
由图3-d所示,发酵过程中桑葚酵素的还原力随发酵时间增加,呈不断上升然后趋于平稳的趋势,发酵结束时,桑葚酵素的还原力从初始的0.72上升到0.77。还原力的变化趋势区别于其他抗氧化指标的原因与其抗氧化机制相关。
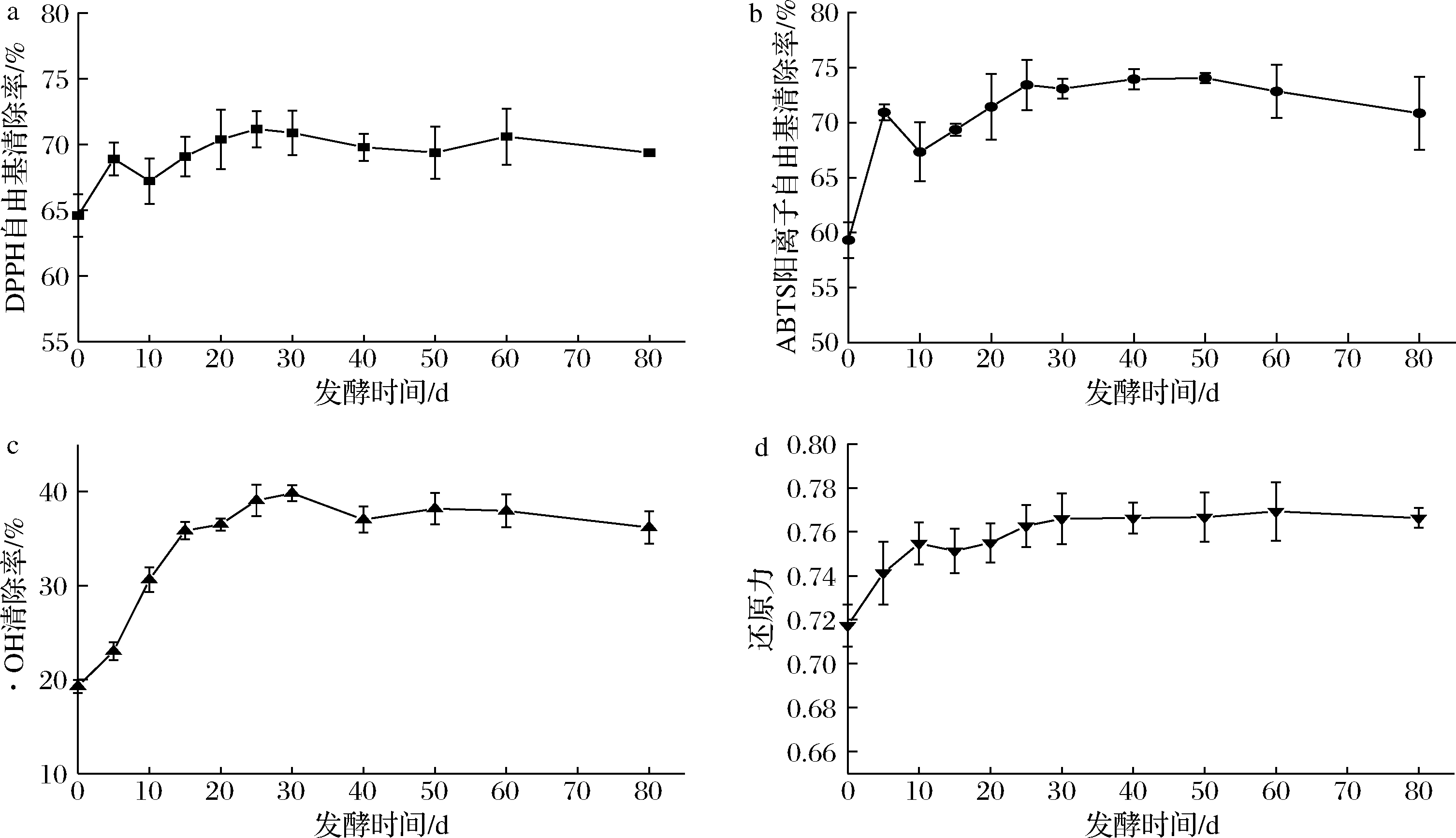
a-DPPH自由基清除率;b-ABTS阳离子自由基清除率;c-·OH清除率;d-还原力
图3 桑葚酵素发酵过程中体外抗氧化指标的变化
Fig.3 Changes of antioxidant indexes in vitro during fermentation of mulberry Jiaosu
2.4 发酵过程中有机酸种类和含量的变化
对桑葚酵素有机酸含量进行测定,由图4可知,桑葚原料不含丙酮酸,经过发酵后,共检出8种有机酸,其中酒石酸、乳酸、乙酸、柠檬酸、琥珀酸的含量较高,最高含量分别达到11.02、13.77、9.63、4.02、2.57 g/L,而草酸、丙酮酸、苹果酸含量一直在1.0 g/L以下变化,说明桑葚酵素中的主要有机酸可能是酒石酸、乳酸、乙酸、柠檬酸和琥珀酸。
乳酸和乙酸是有机酸中占比最高、变化最大的酸。原料中乳酸和乙酸的含量分别为0.46 g/L和0.77 g/L,在发酵过程中先增加后减少,发酵结束时,其含量分别为11.10 g/L和7.05 g/L。因为乳酸菌和醋酸菌是酵素发酵过程中的优势菌种,发酵会产生大量的乳酸和乙酸,使总酸升高,pH值降低,从而又抑制了乳酸菌和醋酸菌的繁殖[22]。柠檬酸在发酵过程中没有明显的变化规律,这可能是因为柠檬酸参与三羧酸循环,在发酵过程中不易累积[23]。酒石酸作为桑葚原料中含量最多的有机酸,经发酵后,呈先上升后下降的趋势。酒石酸的增加可能是由于pH值的急剧降低和原料的溶出造成的,然后因氧化降解或沉淀而减少[24]。

图4 桑葚酵素发酵过程有机酸含量的变化
Fig.4 Changes of organic acid content in mulberry fermentation process
2.5 发酵过程中各指标与抗氧化的相关性分析及主成分分析
2.5.1 各指标变化与抗氧化性活性的相关性分析
表1展示了桑葚酵素发酵过程中各指标变化与4种不同抗氧化活性的相关性,除柠檬酸外,其它成分与4种抗氧化指标均呈极显著的相关性(P<0.01)。其中pH、还原糖与抗氧化能力呈极显著的负相关,其他活性成分则与抗氧化能力呈极显著的正相关(P<0.01)。证明总酚、总黄酮类及有机酸含量对桑葚酵素的抗氧化活性有很大影响。
表1 桑葚酵素发酵过程中各成分与抗氧化指标的相关性
Table 1 Correlation between antioxidant indexes and components in mulberry fermentation process
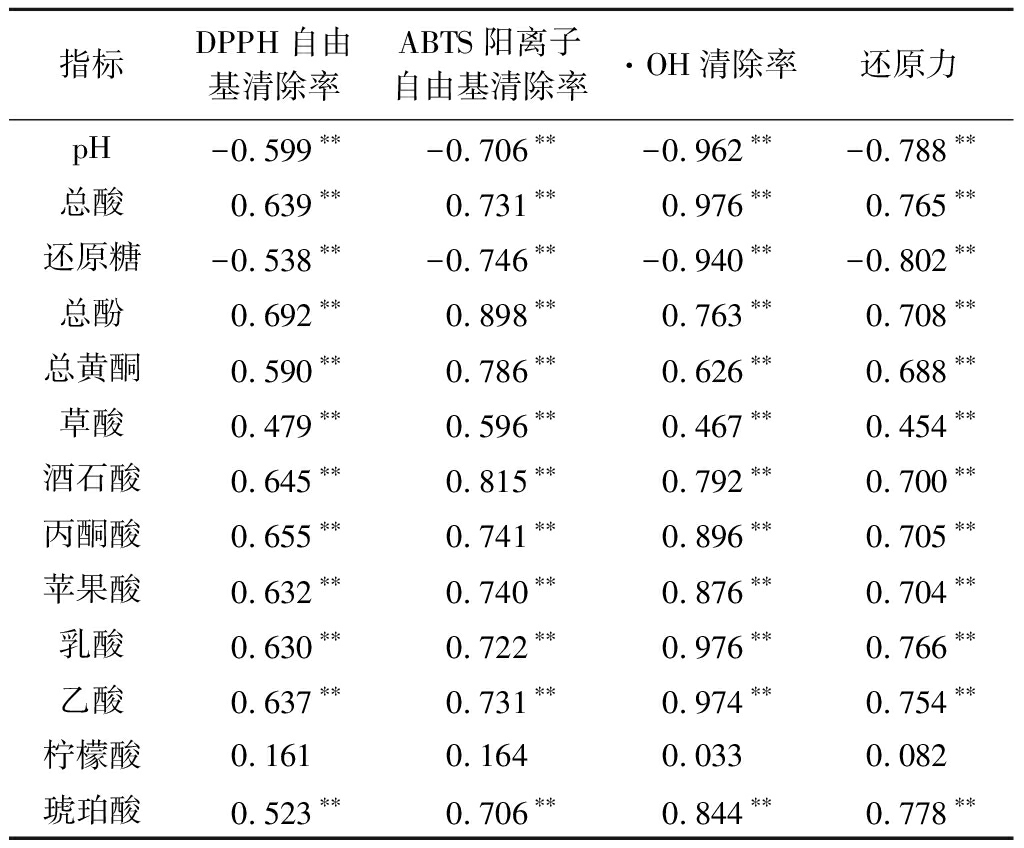
注:**表示差异极显著(P<0.01)
2.5.2 主成分分析
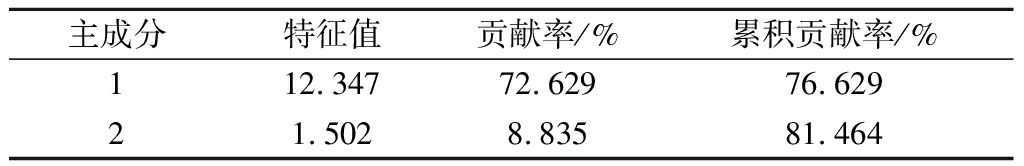
为进一步挖掘桑葚酵素活性物质与抗氧化指标的相关性,应用主成分分析法对上述指标加以分析,得到主成分相关矩阵的特征值、贡献率如表2所示,2个主成分累积贡献率为81.464%(>80%),基本包含大多数样本信息。
表2 解释的总方差
Table 2 The total variance explained
主成分分析载荷图如图5所示,各指标之间相关性强的变量聚集在一起,距离越近,相关性越大。第3象限中,苹果酸、丙酮酸、乙酸、乳酸、总酸与·OH清除能力具有很高的相关性,且与pH和还原糖呈极显著的负相关。第2象限中,ABTS阳离子自由基清除率与总酚距离最近,说明二者相关性极显著,除柠檬酸外,其余成分之间也存在一定的正相关性,此结果与上述相关性分析相似。

图5 主成分分析载荷图
Fig.5 Principal component analysis loading plot
主成分样品得分图如图6所示。发酵0 d和5 d离其他位置相对较远,说明这2个样品与其它样品之间差异较大。发酵10、15 d和20、25、30 d在第2主成分上的差别都不大,但在第1主成分上,发酵10、15 d得分为正值,20、25、30 d得分为负值。发酵40、50、60、80 d主要集中在第2象限,各样品之间无显著差异。
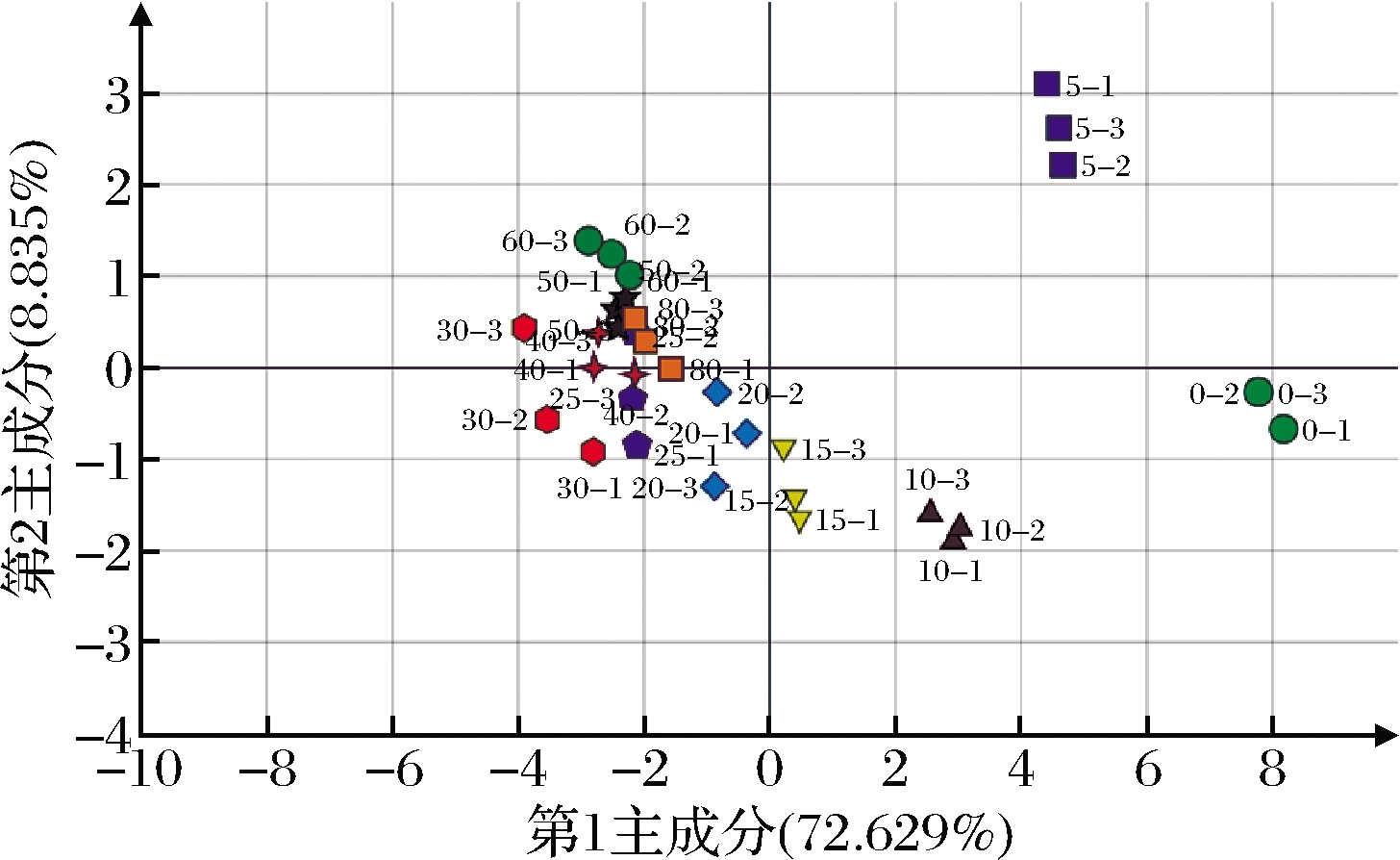
图6 主成分样品得分图
Fig.6 Scoring plot of principal component samples
基于主成分分析法,对不同发酵时间桑葚酵素构建综合评价指数体系。以表2的两个主成分对应的方差相对贡献率为权重,得到桑葚酵素综合评价指数 (comprehensive evaluation index, CEI)计算如公式(1)所示:
(1)
式中:CEI,综合评价指数;PC1,第1主成分;PC2,第2主成分。
不同发酵时间桑葚酵素样品的综合评价指标如图7所示,CEI在0~5 d变化不大,可能是在高糖环境下,微生物处于适应期。发酵5~15 d,CEI迅速上升,发酵15 d以后,CEI上升缓慢,到30 d时达到最大值,为0.90。此后,CEI逐渐下降并趋于平稳。参考CEI,可判断桑葚酵素的发酵终点为30 d。
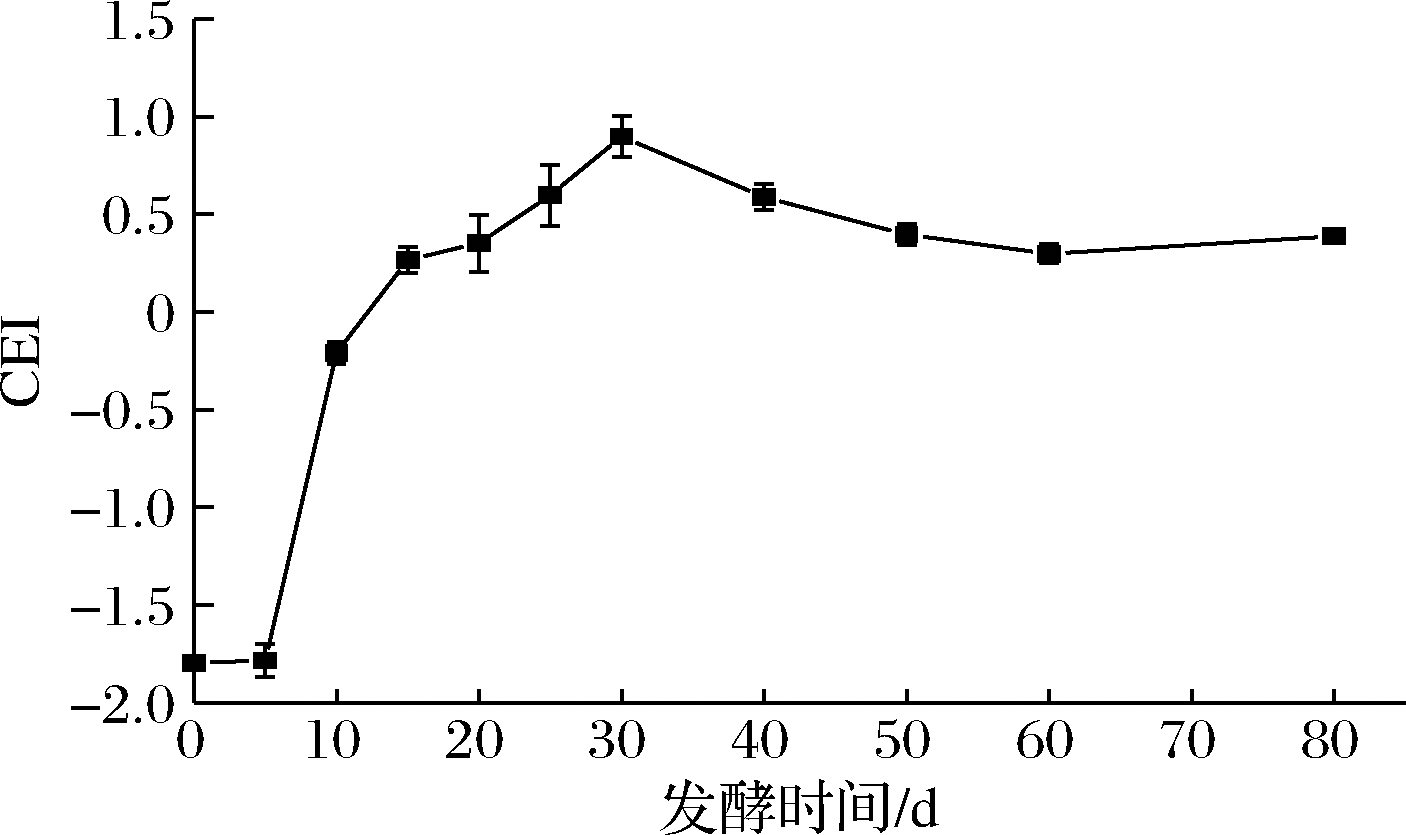
图7 桑葚酵素综合评价指标
Fig.7 Comprehensive evaluation index of mulberry Jiaosu
3 结论
对桑葚酵素发酵过程中的功能活性物质及体外抗氧化能力变化进行分析,发现总酚和总黄酮呈先上升后下降的趋势,于40 d时分别达到最大值3.42 g/L和3.60 g/L,且多酚类物质含量的变化与体外抗氧化能力变化呈显著的正相关性;经发酵,桑葚酵素中共检出8种有机酸,酒石酸、乳酸、乙酸、柠檬酸、琥珀酸作为桑葚酵素中的主要有机酸,含量最高达到11.02、13.77、9.63、4.02、2.57 g/L,且除柠檬酸外的有机酸在发酵过程中的变化均与抗氧化指标呈显著的正相关,表明这些活性物质是影响桑葚酵素抗氧化能力的重要因素。通过对所有指标进行综合性分析,桑葚酵素可分为4个发酵阶段:发酵初期(0~5 d)、发酵中期(5~15 d)、发酵后期(15~30 d)及后熟期(30~80 d),CEI于30 d达到最大值,结合时间成本考虑,可将30 d确定为桑葚酵素的发酵终点。这将为缩短桑葚酵素发酵周期、提高桑葚酵素抗氧化力提供理论基础。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



