奶豆腐中戊糖片球菌的分离鉴定及其产胞外多糖的益生活性
多糖是一类天然高分子聚合物,广泛存在于植物、动物、藻类和微生物中,通常由10个以上单糖通过直链或支链糖苷键连接而成[1]。胞外多糖(exopolysaccharides,EPS)是微生物在生长过程中分泌到细胞外的多糖化合物,具有使细胞免受外界不利环境因素影响、参与黏附和定植等生理作用[2-4]。根据单糖组成的不同,EPS可分为由一种单糖组成的同多糖和由两种及以上单糖组成的杂多糖。乳酸菌是发酵糖类产物主要为乳酸的一类无芽孢、革兰氏阳性细菌的总称[5]。乳酸菌是传统的发酵剂,在食品工业中有着悠久的应用历史[6],是公认的安全微生物(Generally Recognized as Safe, GRAS)[7],其代谢所产的EPS也被普遍认为是食用安全的[8]。产EPS的乳酸菌可应用于酸乳的生产,在发酵过程中原位产生的EPS可提高酸乳的黏度,改变酸乳的流变特性[9]。除此之外,乳酸菌所产EPS还具有多种有益健康的生理活性。
乳杆菌、乳球菌、链球菌和片球菌等乳酸菌均可以产生不同结构的EPS。戊糖片球菌(Pediococcus pentosaceus)是重要的乳酸菌之一,目前关于戊糖片球菌EPS的研究较少,已有报道的戊糖片球菌EPS潜在生理活性包括抗炎、抑菌、抗肿瘤、抗氧化、降血糖等。从泰国热带水果中分离出产EPS的戊糖片球菌LY45[10],所产EPS由甘露糖、葡萄糖、半乳糖组成,能够抑制透明质酸酶活性,其IC50与抗炎剂色甘酸钠和甘草酸二钾相同。海洋来源的戊糖片球菌M41[11]所产EPS主要由阿拉伯糖、甘露糖、葡萄糖和半乳糖组成,分子质量为682.07 kDa,有抗氧化能力(DPPH和ABTS),能抑制与糖尿病有关的α-淀粉酶和α-葡糖苷酶活性,抑制结肠癌细胞Caco-2和乳腺癌细胞MCF-7生长。关于戊糖片球菌EPS影响益生菌生长的研究报道相对较少。本文从内蒙古牧民自制的奶豆腐中分离鉴定出一株产EPS的戊糖片球菌,研究了该菌株对酸和胆盐耐受性及模拟消化后的存活率,进一步探究了其所产EPS的结构,及其作为唯一碳源对乳杆菌增殖的影响。研究结果有望为乳酸菌资源的开发和EPS的应用提供一定的基础和数据支撑。
1 材料与方法
1.1 材料与试剂
奶豆腐,内蒙古家庭自制;MRS肉汤培养基、猪胆盐,北京奥博星生物技术有限公司;琼脂,北京拜尔迪生物技术有限公司;NaCl、CaCO3、三氯乙酸,上海麦克林生化科技有限公司;盐酸、硫酸,国药集团化学试剂有限公司;葡聚糖标准品,美国聚合物标准品公司(APSC);葡萄糖,现代东方(北京)科技发展有限公司;细菌通用引物27F和1492R,生工生物工程(上海)股份有限公司;细菌基因组DNA提取试剂盒,天根生化科技有限公司;HBI乳酸菌生化鉴定条(GB),海博生物;透析袋,上海源叶生物技术有限公司。
干酪乳杆菌AS 1.62(BNCC 137633)、德氏乳杆菌NRRL B-548(ATCC 7993)、干酪乳杆菌NRRL B-1922(ATCC 393)、德氏乳杆菌AS 1.2625(AS 1.2132,JCM 1248)、棒状乳杆菌NRRL B-4391(ATCC 25602)、罗伊氏乳杆菌CICC 6132(ATCC 23272)、嗜酸乳杆菌NRRL B-4495(ATCC 4356)、短乳杆菌NRRL B-4527(ATCC 14869),中国农业大学食品科学与营养工程学院酶与发酵工程实验室购买或保藏。
1.2 仪器与设备
DNP-905型电热恒温培养箱,上海精宏实验设备有限公司;DL-CJ-1 ND Ⅱ型洁净工作台,北京东联哈尔滨仪器制造有限公司;UV-1200型紫外可见分光光度计,上海美谱达仪器有限公司;Multiskan FC型酶标仪,赛默飞世尔(上海)仪器有限公司;LGJ-25D型冷冻干燥机,北京四环启航科技有限公司;PB-10型pH计,德国Sartorius;LDZX-50KBS型立式高压蒸汽灭菌锅,上海申安医疗器械厂;SIGMA-3K15型台式高速冷冻离心机,德国SIGMA;1260 Infinity Ⅱ LC型安捷伦液相色谱系统,美国安捷伦;IKA HB-10旋转蒸发仪,德国IKA公司;T100型Thermal Cycler PCR仪,美国BIO-RAD公司;傅立叶红外变换光谱,美国Perkin Elmer公司。
1.3 实验方法
1.3.1 菌株的分离与筛选
采用无菌生理盐水(8.5 g/L)对奶豆腐样品(1.0 g)进行梯度稀释后涂布于含10 g/L CaCO3的MRS固体培养基,30 ℃培养24~48 h后挑取具有溶钙圈的单菌落,接种至液体MRS培养基继续培养24~48 h(30 ℃),菌株培养液离心(4 000 r/min,4 min),弃上清液,沉淀加入与原培养液相同体积的甘油与脱脂乳混合液(1∶3,v/v)后于-80 ℃冷冻保藏。
菌株经两代活化后按接种量2%接种于MRS肉汤培养基,30 ℃培养24 h后沸水浴处理10 min。冷却后向发酵液中加入800 g/L的三氯乙酸至终浓度40 g/L,充分混匀后4 ℃静置过夜,离心(10 000×g,20 min)除去菌体和蛋白。收集上清液并加入3倍体积无水乙醇,充分混匀后4 ℃静置过夜,离心(10 000×g,20 min)后收集沉淀。沉淀加入适量水溶解,经透析(截留分子质量8 000~14 000 Da)后用去离子水定容到原体积,采用苯酚—硫酸法测定多糖含量,以葡萄糖为标准品做标准曲线,选取EPS产量高的菌株进行后续鉴定。
1.3.2 菌株的鉴定
菌落形态和生理生化鉴定:选取高产EPS菌株连续平板划线后30 ℃培养获得单菌落,观察菌落形态,革兰氏染色后显微镜观察微生物细胞颜色及形态。参照《伯杰细菌鉴定手册》第八版及GB 4789.35—2016《食品安全国家标准 食品微生物学检验 乳酸菌检验》对菌株进行生理生化分析。
16S rDNA测序分析:采用试剂盒提取菌株DNA,设计通用引物(上游引物27F:5′-GAGTTTGATCCTGGCTCAG-3′;下游引物1492R:5′-ACGGCTACCTTGTTACGACTT-3′)对DNA进行PCR扩增。PCR扩增反应体系25 μL,上游引物1 μL,下游引物1 μL,水9.5 μL,目的基因1 μL,2×M5 HiPer plus Taq HiFi PCR mix(with blue dye)12.5 μL。反应条件为95 ℃预变性3 min,94 ℃变性25 s,55 ℃退火25 s,72 ℃延伸30 s,30个循环,72 ℃最终延伸10 min,12 ℃保温10 min。采用0.8%的琼脂糖凝胶电泳对扩增产物分析并送上海擎科生物科技有限公司测序。测定的16S rDNA序列通过NCBI进行Blast分析比对,利用Mega10构建系统进化树。
1.3.3 戊糖片球菌S28的酸、胆盐耐受性及模拟胃肠道消化
耐酸性分析:戊糖片球菌 S28经两代活化后接种于不同pH(盐酸调节pH为6.2,6.0,5.5,5.0,4.5,4.0,3.5,3.0)的MRS培养基(2%,体积分数),37 ℃培养72 h,采用酶标仪监测培养过程中OD595变化。
耐胆盐分析:制备含胆盐的MRS培养基(3,5,10 g/L)并接种两代活化后的戊糖片球菌 S28(2%,体积分数),37 ℃培养3 h后测定活菌数。
模拟胃肠道消化:两代活化后的戊糖片球菌S28与模拟胃液(6.9 mmol/L KCl,0.9 mmol/L KH2PO4,25 mmol/L NaHCO3,47.2 mmol/L NaCl,0.1 mmol/L MgCl2, 0.5 mmol/L(NH4)2CO3,0.15 mmol/L CaCl2,4 000 U/mL胃蛋白酶,pH 3.0)体积比1∶1混合,37 ℃条件下处理2 h后取样,混合液与模拟肠液(6.8 mmol/L KCl,0.8 mmol/L KH2PO4,85 mmol/L NaHCO3,38.4 mmol/L NaCl,0.33 mmol/L MgCl2,0.6 mmol/L CaCl2,200 U/mL 胰酶,胆盐0.3%,pH 7.0)体积比1∶1混合,37 ℃条件下继续处理2 h后取样,测定消化前后混合液中活菌数,按公式(1)计算存活率:
存活率![]()
(1)
1.3.4 EPS组成及结构分析
按照1.3.1浓缩冻干后制备EPS。
分子质量测定:EPS溶于去离子水(1 mg/mL),经膜过滤(0.22 μm)后采用凝胶排阻色谱测定EPS分子质量。色谱条件如下:色谱柱TSK gel GMPWXL(7.8 mm×300 mm),示差折光检测器,柱温35 ℃,流动相为去离子水,流速0.6 mL/min,进样量10 μL。以不同分子质量葡聚糖为标准品(重均分子质量分别为1 200、4 300、36 300、97 000、275 900、821 700和3 755 000 Da)制作标准曲线并计算EPS分子质量。
单糖组成测定:8.02 mg干燥的EPS,加入三氟乙酸(2 mol/L,2.0 mL)后封管,110 ℃酸解8 h。氮吹干后加入2.0 mL去离子水复溶。取250 μL水解产物溶液样品,加入250 μL NaOH 溶液(0.6 mol/L)及500 μL 1-苯基-3-甲基-5-吡唑啉酮(1-phenyl-3-methyl-5-pyrazolone,PMP)-甲醇(0.4 mol/L),70 ℃反应1 h。冷却后加入500 μL HCl溶液(0.3 mol/L)中止反应。用1 mL氯仿对PMP衍生物进行萃取(重复3次),高效液相色谱分析EPS单糖组成。色谱条件如下:岛津LC-20AD HPLC,色谱柱为Xtimate C18(4.6 mm×200 mm,5 μm),柱温30 ℃,紫外检测器,波长250 nm,流动相为0.05 mol/L KH2PO4溶液(pH 6.7)∶乙腈=83∶17(体积比),流速1.0 mL/min,进样量20 μL。甘露糖、核糖、鼠李糖、葡萄糖、半乳糖、木糖、阿拉伯糖、岩藻糖、葡萄糖醛酸、半乳糖醛酸、N-乙酰-氨基葡萄糖及N-乙酰-氨基半乳糖为标准品,分析EPS的组成及含量。
红外光谱分析:EPS经冷冻干燥后研磨制成粉末,采用衰减全反射-傅立叶红外光谱仪对EPS的结构进行分析,波长范围为4 000~500 cm-1,扫描次数32,分辨率4,数据间隔2 cm-1,记录EPS红外光谱图。
1.3.5 EPS对益生菌生长的影响
选择8株乳杆菌,活化后接种至以20 g/L EPS为唯一碳源的MRS培养基,37 ℃培养24 h,测定培养过程中发酵液OD595变化并制作生长曲线,以无糖培养基作为空白对照,以菊粉为唯一碳源的培养基作为阳性对照。
2 结果与分析
2.1 菌株的分离与鉴定
2.1.1 菌株的形态学和生理生化鉴定
从奶豆腐样品中分离出32株具有溶钙圈的菌株,采用苯酚-硫酸法测定其发酵液中EPS产量。分析结果表明,菌株S28的发酵液中EPS产量最高,达(126.43±4.32) mg/L。对该菌株进行形态学观察,如图1-a所示,菌株S28革兰氏染色后显微镜观察呈球状,成对排列,为革兰氏阳性。如图1-b所示, 菌株在加入CaCO3的MRS固体培养基上为白色圆形,菌落凸起,边缘整齐,表面有光泽。菌落周围有透明的溶钙圈,表明菌株S28在生长过程中产酸。
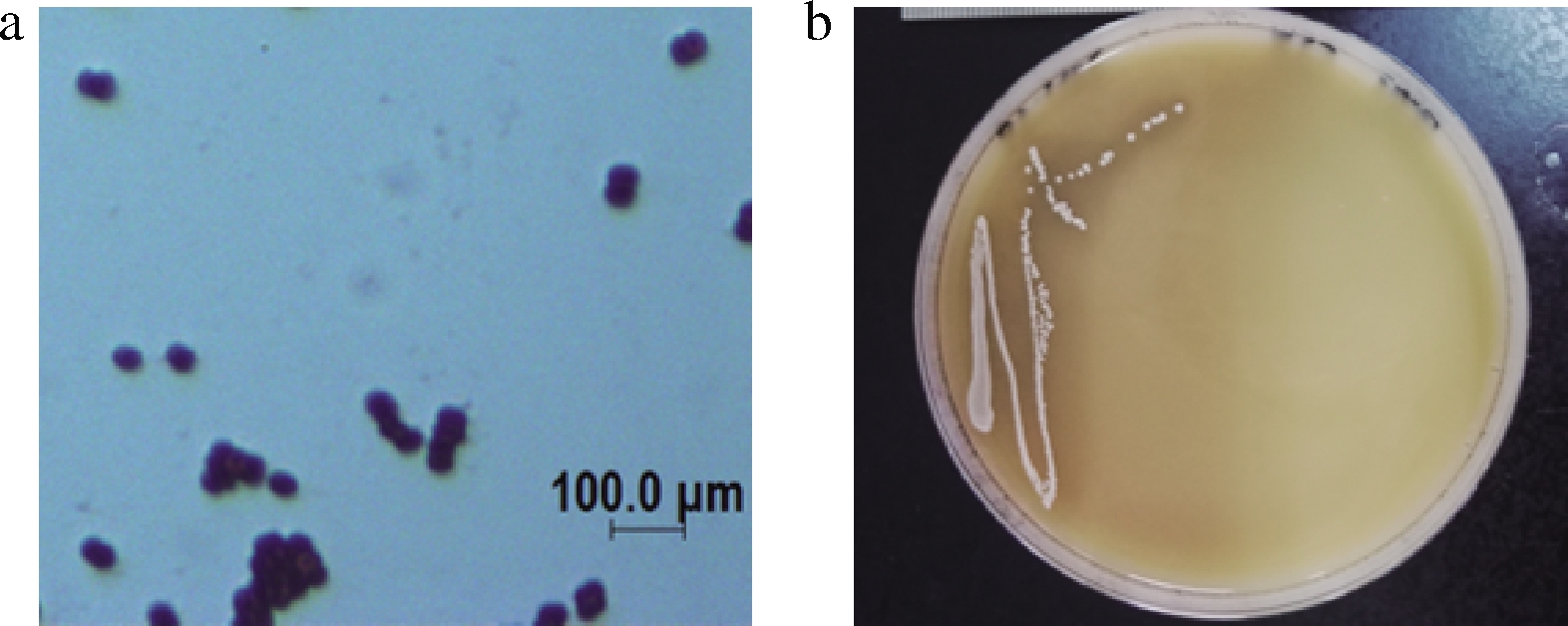
a-革兰氏染色(30 ℃培养14 h),b-菌落形态(30 ℃培养48 h)
图1 菌株S28革兰氏染色及菌落形态
Fig.1 Gram staining and colony morphology of strain S28
如表1所示,菌株S28能够在4~45 ℃,pH 9.0和9.6的碱性环境和浓度为2%~4%的NaCl中生长,但不能在6%的NaCl中生长。在菌株S28的碳水化合物反应中乳糖、麦芽糖、七叶苷、纤维二糖、水杨苷呈阳性,山梨醇、甘露醇、蔗糖、棉子糖、菊糖呈阴性,过氧化氢酶、尿素酶、明胶液化、吲哚实验、V-P均呈阴性,MR和淀粉水解实验呈阳性。菌株S28在固体培养基中能够沿刺穿线扩散生长,具有一定的运动性。
表1 菌株S28的生理生化鉴定结果
Table 1 Physiological and biochemical characterizations of strain S28
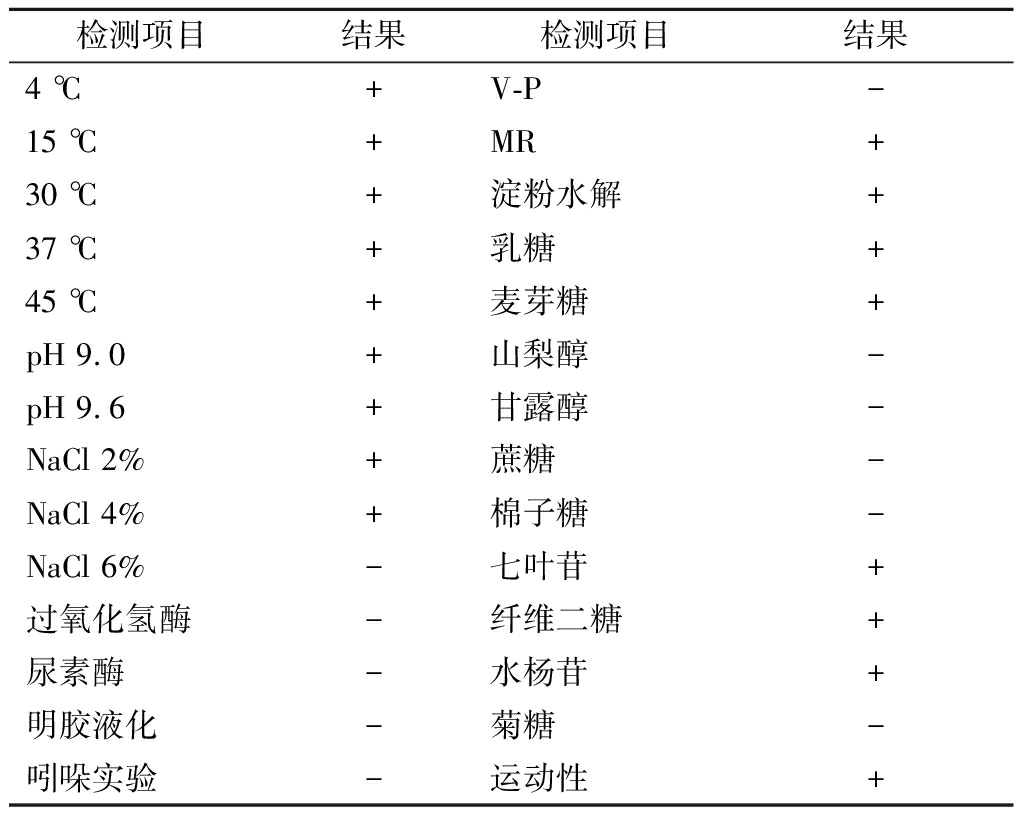
注:“+”表示阳性,“—”表示阴性。
2.1.2 菌株16S rDNA鉴定
菌株S28进行16S rDNA测序后绘制系统发育树,多序列同源性对比结果如图2所示。菌株S28与P.pentosaceus DSM 20336同源性达99%。因此,将菌株S28命名为戊糖片球菌S28。
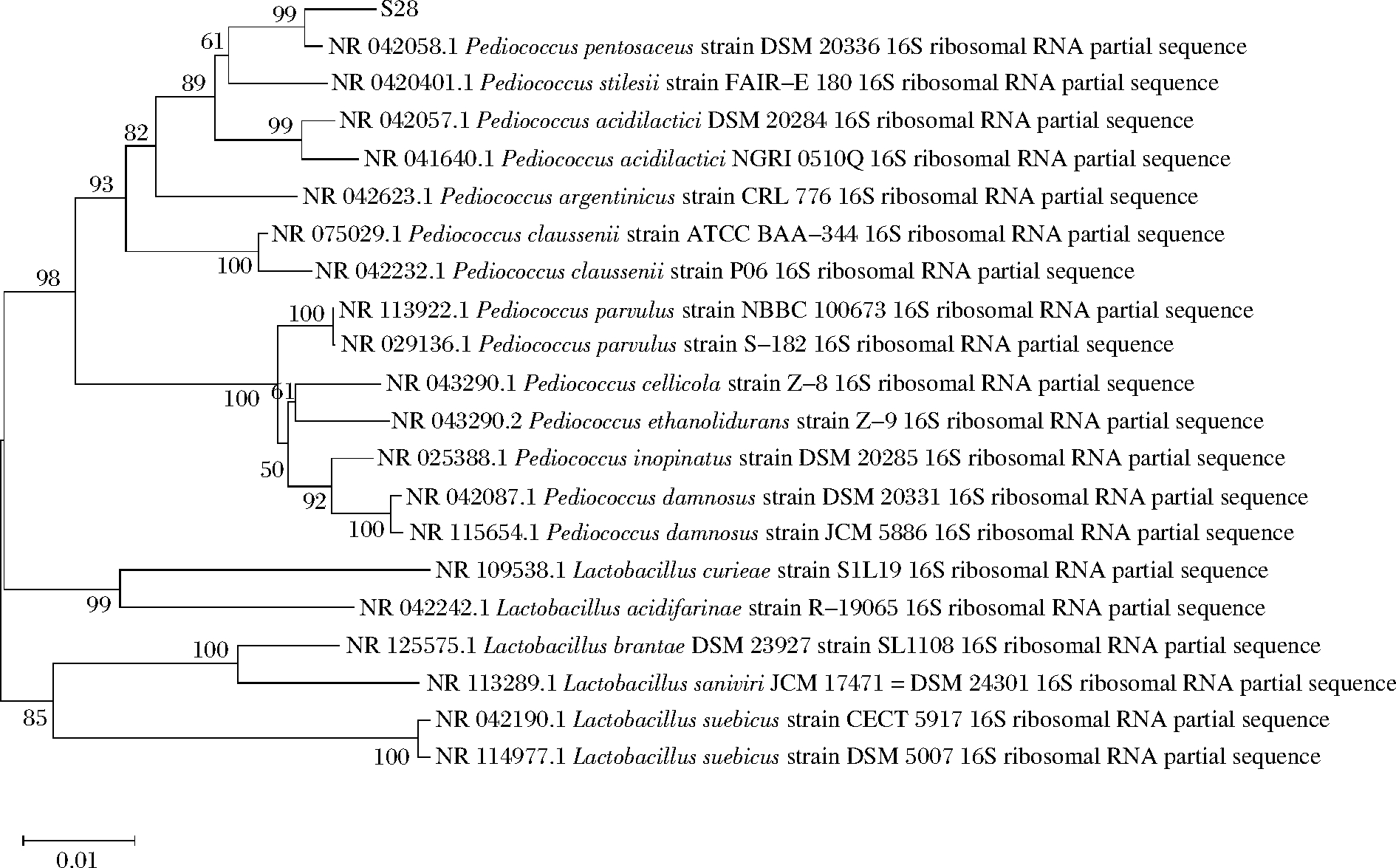
图2 基于16S rDNA的系统发育树
Fig.2 Phylogenetic tree based on 16S rDNA sequences
2.2 戊糖片球菌S28的耐受性及模拟胃肠道消化
戊糖片球菌S28在pH 4.5~6.2范围内均能够正常生长(图3-a),当pH<4.0时,发酵液OD595与初始时无明显增加,说明戊糖片球菌S28无法正常生长繁殖。戊糖片球菌S28经活化后接种于含胆盐MRS培养基(初始活菌数为8.26×105 CFU/mL)。戊糖片球菌S28在较高浓度的胆盐中培养3 h均能存活(图3-b),说明该菌株对胆盐具有一定的耐受性。
戊糖片球菌S28(初始活菌数1.46×109 CFU/mL)在胃液消化后存活率为(56.26±11.72)%,在肠液消化后存活率为(35.01±10.91)%。
2.3 戊糖片球菌S28 EPS的分子质量
凝胶过滤测定分子质量,EPS在色谱图中呈现出较为对称的尖锐单峰,由葡聚糖标准曲线计算得出EPS的分子质量为9.82×105 Da。
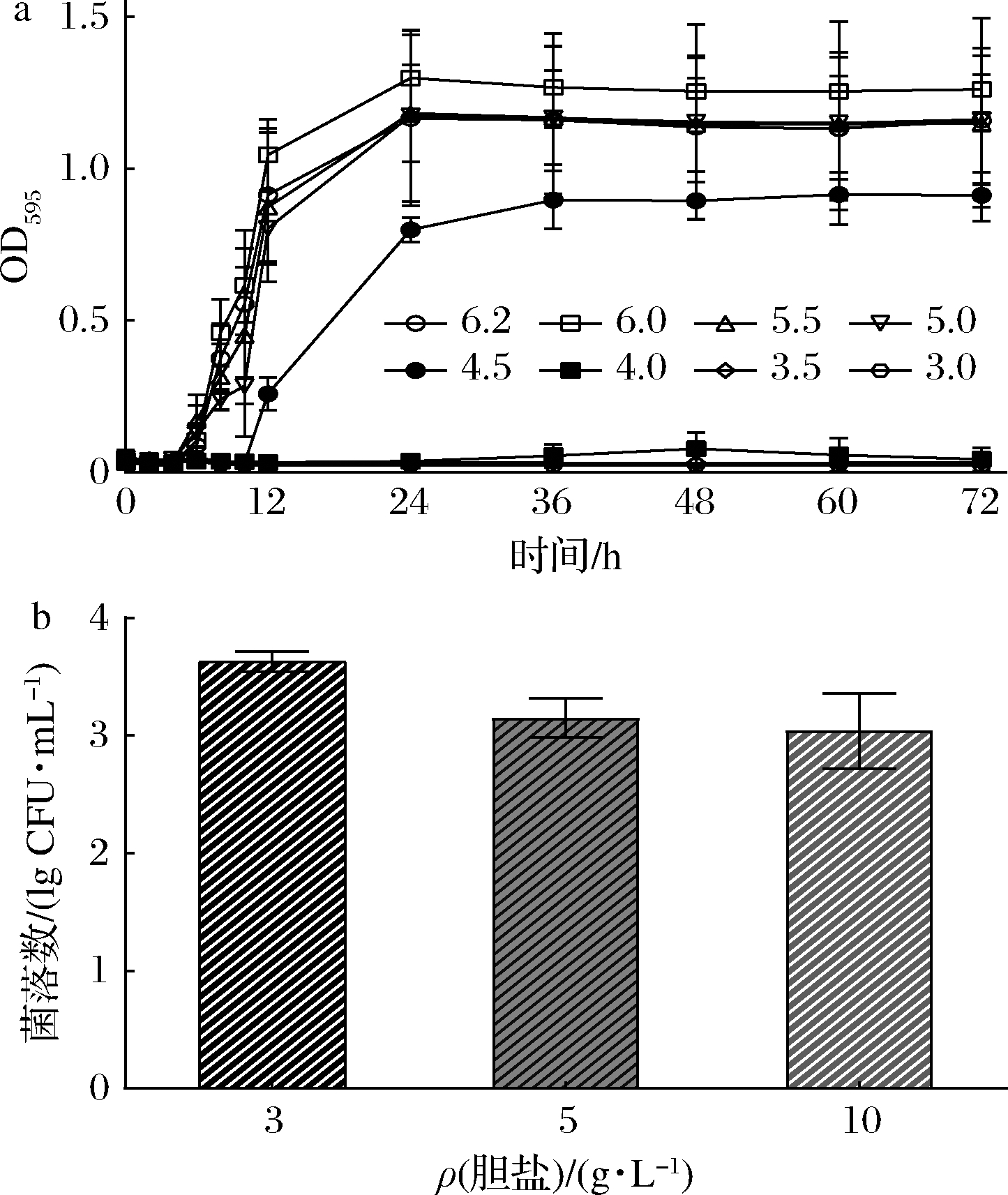
a-pH;b-胆盐浓度
图3 戊糖片球菌S28在不同pH和胆盐中的生长情况
Fig.3 Growth of P.pentosaceus S28 in different pHs and bile salts
2.4 戊糖片球菌S28 EPS的单糖组成及初步结构分析
戊糖片球菌S28 EPS为杂多糖,主要由甘露糖、葡萄糖、半乳糖组成,其峰面积分别占32.38%、33.20%、26.16%,比例超过91%(图4)。戊糖片球菌S28 EPS还含有少量葡萄糖醛酸(4.82%)、木糖(0.76%)、阿拉伯糖(0.90%)及岩藻糖(1.78%)。
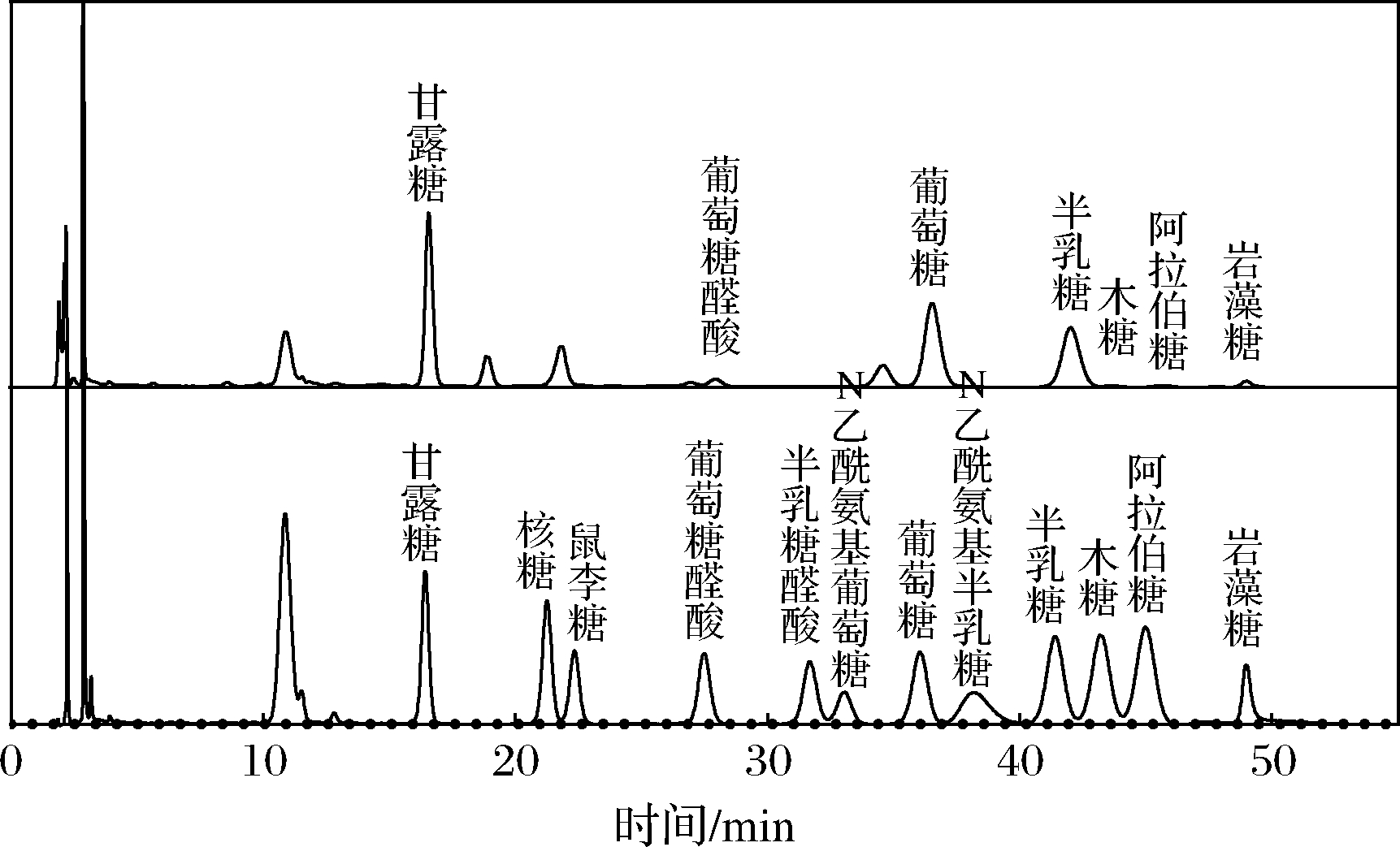
图4 戊糖片球菌S28 EPS单糖组成分析
Fig.4 Monosaccharide composition analysis of EPS from P.pentosaceus S28
戊糖片球菌S28产EPS在3 277 cm-1处强烈的拉伸带(图5),说明EPS中存在大量羟基。在2 925 cm-1处的伸缩带是C—H键(—CH2—或—CH3—)伸缩振动产生的。在1 640 cm-1和1 308 cm-1处的吸收表示戊糖片球菌S28 EPS中存在羧基。在1 542 cm-1处的吸收可能是由C—O振动所产生。1 200~800 cm-1是多糖的指纹图谱区,1 214 cm-1处的峰是O—H键的伸缩振动峰。1 028 cm-1的吸收可能是C—O—C的伸缩振动产生的。
2.5 EPS在体外对益生菌生长的影响
采用体外单菌培养方法对EPS的益生活性进行分析。戊糖片球菌S28 EPS对益生菌的增殖具有菌株特异性(图6)。德氏乳杆菌NRRL B-548、罗伊氏乳杆菌CICC 6132、干酪乳杆菌AS 1.62、干酪乳杆菌NRRL B-1922能够利用戊糖片球菌S28所产EPS作为唯一碳源生长繁殖,发酵24 h后,发酵液OD595虽然低于阳性对照菊粉,但显著高于阴性对照组。而短乳杆菌NRRL B-4527、棒状乳杆菌NRRL B-4391、嗜酸乳杆菌NRRL B-4495和德氏乳杆菌AS 1.2625不能利用EPS生长,培养24 h后发酵液OD595与阴性对照无糖培养基相近。
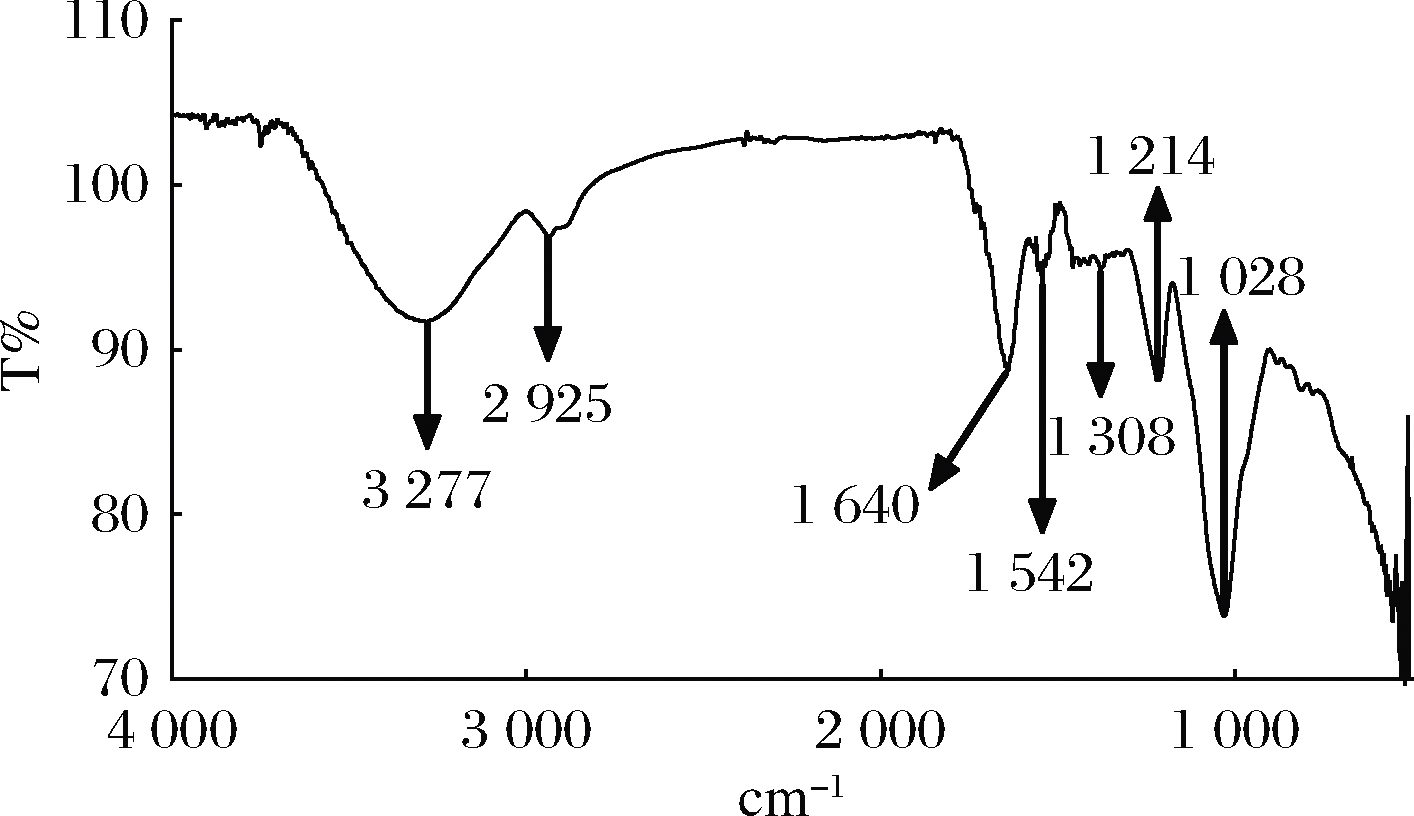
图5 戊糖片球菌S28 EPS的红外光谱图
Fig.5 Infrared spectrum of EPS from P.pentosaceus S28

a-德氏乳杆菌NRRL B-548;b-罗伊氏乳杆菌CICC 6132;c-干酪乳杆菌 AS 1.62;d-干酪乳杆菌 NRRL B-1922, e-短乳杆菌NRRL B-4527;f-棒状乳杆菌NRRL B-4391;g-嗜酸乳杆菌NRRL B-4495;h-德氏乳杆菌 AS 1.2625
图6 戊糖片球菌S28 EPS对益生菌生长的影响
Fig.6 Effects of EPS from P.pentosaceus S28 on the growth of probiotics
3 结论与讨论
本研究从自然界中分离出一株产胞外多糖的菌株S28,根据其有溶钙圈、革兰氏阳性、过氧化氢酶阴性等特征,初步判断其为乳酸菌[12],经16S rDNA测序分析后鉴定为戊糖片球菌。乳酸菌要发挥其功能则需要定植于肠道中[5],乳酸菌进入消化道后不仅要面对胃部低pH(进食后上升到3.0以上)[13]与肠道胆盐(质量分数0.03%~0.3%)[14]的胁迫,还要抵御各种消化酶的消化。戊糖片球菌S28能在pH 4.5~6.2的酸性条件下大量生长,不能在pH 4.0的条件下生长。在ABID等[15]的研究中,戊糖片球菌DPS也无法在pH 3.6的条件下生长,与本研究中戊糖片球菌S28的情况相似。戊糖片球菌S28对肠道中的不利环境具有耐受性,在3~10 g/L的高浓度胆盐条件下仍能够存活,在连续模拟胃肠道消化后仍有一定数量的活菌。
本研究对戊糖片球菌S28 EPS的结构进行初步研究,测定其分子质量为9.82×105 Da。不同乳酸菌EPS的分子质量差异很大,乳酸菌所产杂多糖的分子质量在4×104~9×106 Da,同多糖分子质量常常高于106 Da[16],戊糖片球菌EPS的分子质量从4×104~1.2×106 Da不等[15,17]。戊糖片球菌S28所产EPS分子质量较高,高分子质量的EPS在改善食品结构方面有巨大潜力[9,18]。目前已报道的戊糖片球菌EPS单糖组成包括葡萄糖、甘露糖、半乳糖以及N-乙酰-氨基葡萄糖[10,17]。戊糖片球菌S28 EPS主要由甘露糖、葡萄糖和半乳糖等组成,与戊糖片球菌LY45[10]所产EPS单糖组成相同。
国际益生菌和益生元科学协会(ISAPP)将益生元定义为能被宿主体内微生物选择性利用并有益于宿主健康的物质[19]。目前关于乳酸菌EPS的报道多集中于抗氧化等活性研究,关于其作为潜在益生元影响益生菌生长的研究报道相对较少。ZHU等[20]采用体外发酵模型研究发现,来自健康志愿者粪便样本中的肠道微生物可以发酵鼠李糖乳杆菌ZFM231产生EPS,增加Ruminococcus, Dorea, Butyricicoccus和Blautia的丰度,并产生短链脂肪酸。瑞士乳杆菌MB2-1所产EPS能够促进10种益生菌(1株肠球菌和9株乳杆菌)生长,与普通碳源培养基相比,该EPS还一定程度上抑制了2株大肠杆菌的生长[5]。益生菌对EPS的利用通常具有菌株特异性。例如,两歧双歧杆菌能够利用戊糖片球菌5S4所产EPS,但植物乳杆菌和嗜酸乳杆菌则不能代谢该EPS[21]。益生活性分析结果表明,植物乳杆菌突变菌株所产EPS对亲本菌株、突变菌株、乳酸片球菌、干酪乳杆菌、植物乳杆菌、德氏乳杆菌乳酸亚种的益生活性为阳性,对其余乳酸菌均为阴性[22]。EPS的组成、结构和分子质量等可能会影响乳酸菌对其利用。9株乳杆菌在单糖组成相同但比例不同的3个EPS组分(德氏乳杆菌保加利亚亚种SRFM-1所产EPS)中的生长情况分析表明,大多数菌株首先选择利用β(1-4)糖苷键连接的β-半乳糖残基,这可能是由于菌株所产相关酶在与由α/β(1-6)糖苷键连接而成的EPS的接触过程中存在空间阻碍导致的[23]。本研究中乳杆菌对戊糖片球菌S28所产EPS利用情况与已报道结果不同,可能是由于不同乳杆菌所产的与糖代谢相关的酶不同。
对戊糖片球菌S28的耐受性及其EPS的研究表明,戊糖片球菌S28可作为潜在益生菌,且其发酵产EPS还可作为益生元应用于功能食品中。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



