清香型小曲白酒酿造中酵母资源解析及其耐受性能研究
酵母是白酒酿造中三大主要功能微生物类群之一,其在糖化和发酵过程中数量与种类不断变化,促进了底物转化为乙醇并形成多种香味物质[1-2]。在我国,由于地理环境和酿造工艺的不同使得白酒在发展中形成了多种香型,如清香型、浓香型和酱香型,从而导致酵母菌群的种类、分布也存在一定的差异[3-5]。相比于酱香和浓香型白酒,对清香型白酒中酵母种类研究较少,主要集中在酿酒酵母、汉逊酵母、东方伊萨酵母及假丝酵母等[6-8]。因此,从清香型白酒酒曲中筛选新的优良酵母是持续提升白酒出酒率和酒质的重要方法[9-11]。
近年来高通量测序技术在清香型小曲白酒酿造微生物的研究中获得重要进展,为小曲白酒微生物的研究指明了方向[12-14]。但其无法获得活的菌株应用于发酵实验,限制了菌株的应用。传统经典分离方法补充了高通量测序技术的弊端,可为生产应用提供大量潜力菌种。此外,在实际生产中,酵母会受到胁迫条件的影响,如高温、高糖、高乙醇环境等,因此生产中对菌株的生理特性有一定的要求,获得菌株并开展对生存环境的耐受性是进行工业应用的基础[15]。
清香型白酒酿造体系复杂,对微生物的变化演替研究成为热点。王薇等[16]从清香型白酒酒曲酒醅中鉴定出10种酵母,除了常见的酿酒酵母、东方伊萨酵母、异常毕赤酵母、扣囊腹膜孢酵母外,阿氏丝孢酵母(Trichosporon asahii)、葡萄牙棒孢酵母(Clavispora lusitaniae)、高渗汉森菌(Hanseniaspora osmophila)、膜醭毕赤酵母(Pichia membranifaciens)、粉状毕赤酵母(Pichia farinosa)和发酵毕赤酵母(Pichia fermentans)均为首次从清香型白酒酿造过程中分离获得的酵母种类。杜艾明等[5]对黄鹤楼清香型白酒酿造体系中酵母进行了研究,主要为酿酒酵母、异常威克汉姆酵母、东方伊萨酵母、扣囊腹膜孢酵母和扁平云假丝酵母,其中酿酒酵母和异常威克汉姆酵母为优势菌。耿添霈等[17]从汾酒缸花中筛选出毕赤酵母(Pichia)、威克汉姆酵母(Wickerhamomyces)、腹膜孢酵母(Saccharomycopsis)、假丝酵母(Candida)与迈耶氏酵母(Meyerozyma)5个酵母属,其中马朗加腹膜孢酵母(Saccharomycopsis malanga)首次在清香型白酒酿造环境中发现。我们前期对劲牌公司小曲白酒酒曲和酒醅中酵母进行筛选,获得几株酿酒酵母和毕赤酵母,种类较少[18],可能是环境中霉菌生长过快影响了酵母的纯化和分离。而近期文献报道,在培养基中添加有机酸可以很好地抑制霉菌生长,有利于酵母的生长[19]。因此,本文以多种常规培养基为基础培养基,通过添加不同比例乳酸和乙酸抑制样品中霉菌菌丝蔓延,从清香型小曲白酒酒曲和酒醅中分离酵母,并结合形态学和26S rRNA分子生物学技术鉴定其种属。同时,对所筛选的酵母的生理特性和环境耐受性进行研究,以期为清香型小曲白酒生产储备优良酵母资源。
1 材料与方法
1.1 仪器与设备
E200生物显微镜,尼康;2720 Thermal Cycler PCR仪,赛默飞世尔科技;DYY-8C电泳仪,北京六一生物科技有限公司;ZF-288全自动凝胶成像分析系统,上海嘉鹏科技有限公司;5424 R离心机,Eppendorf公司;WFJ 2000可见分光光度计,尤尼柯(上海)仪器有限公司;JJ6000电子天平,常熟市双杰测试仪器厂;MJ-250BSH-Ⅱ霉菌培养箱,上海新苗医疗器械制造有限公司;SW-CJ-1B净化工作台,苏州智净净化设备有限公司;YXQ-LS-75SII高压灭菌锅,上海博迅实业有限公司医疗设备厂。
1.2 材料与试剂
1.2.1 实验样品和试剂
分离酵母所用酒醅样品于2019年10~12月取自劲牌公司枫林三分厂酿造三车间,酒曲取自劲牌毛铺制曲车间。
生化试剂:PDA培养基,海博生物技术有限公司;孟加拉红琼脂培养基、蛋白胨、琼脂粉,国药集团化学试剂有限公司;酵母浸粉,北京奥博星生物技术有限公司;青霉素,华北制药股份有限公司;黄豆芽,超市购买;麦芽浸粉,天津市利发隆化工科技有限公司。
分析纯试剂:葡萄糖、丙酸钠、乳酸、乙酸、脱氧胆酸钠、KH2PO4、K2HPO4、MgSO4、KNO3、Na2HPO4、NaH2PO4、KCl、FeSO4、蔗糖、乙二胺四乙酸二钠(EDTA-2Na)、甘油,国药集团化学试剂有限公司。
1.2.2 培养基及试剂配制
PDA培养基:按照PDA合成培养基配方称取适量样品,并加入10 g/L的丙酸钠加热溶解,倾倒平板前加入0.5 g/L的青霉素或3.3 mL/L的乙酸[19](下同)。
YPD培养基(g/L):酵母浸粉10,葡萄糖20,蛋白胨20,琼脂20,倾倒平板前加入0.5 g/L的青霉素。分别加入0.3 g/L脱氧胆酸钠,或3.3 mL/L的乙酸,或V(乙酸)∶V(乳酸)=1∶1(乙酸3.0 mL/L),或V(乙酸)∶V(乳酸)=1∶2(乙酸2.3 mL/L),V(乙酸)∶V(乳酸)=1∶3(乙酸2.0 mL/L)。
孟加拉红培养基(g/L):蛋白胨5,葡萄糖10,KH2PO41,无水MgSO4 0.5,孟加拉红0.033,琼脂20。倾倒平板前加入0.5 g/L的青霉素。分别加入0.3 g/L脱氧胆酸钠,或3.3 mL/L的乙酸。
察氏培养基(g/L):蔗糖30,NaNO3 3,K2HPO4 1,MgSO4 0.5,KCl 0.5,FeSO4 0.01,琼脂20。
豆芽汁葡萄糖培养基(g/L):黄豆芽100,葡萄糖50,琼脂20。称取新鲜黄豆芽100 g,置于烧杯中,加入1 000 mL水,加热至沸腾,维持30 min,用8层纱布趁热过滤,滤渣弃去。滤液补充水分到1 000 mL,即制成10%豆芽汁,再加入葡萄糖煮沸,之后加入琼脂,继续加热融化,再分装,倾倒平板前加入0.5 g/L的青霉素。
麦芽汁琼脂培养基(g/L):麦芽浸粉30、琼脂15。倾倒平板前加入0.5 g/L的青霉素和3.3 mL/L的乙酸。
DNA提取重悬液:50 mmol/L pH 7.4磷酸钠缓冲溶液、1 mmol/L EDTA-2Na、体积分数5%甘油。
以上培养基和重悬液使用前均于121 ℃灭菌20 min。
1.3 实验方法
1.3.1 酵母的分离纯化方法
取5 g酒醅或酒曲样品置于装有95 mL无菌水的三角瓶中,置于150 r/min摇床中,30 min后取出,梯度稀释,分别取200 μL浓度为10-3和10-4CFU/mL的菌悬液分别涂布于YPD培养基、孟加拉红培养基、PDA培养基、豆芽汁葡萄糖培养基、麦芽汁琼脂培养基和察氏培养基上,30 ℃倒置培养2~3 d,对平板上所得到的不同酵母菌落进行划线纯化,将得到的纯化菌株接种到YPD培养基上,培养2~3 d后在4 ℃保藏。
1.3.2 酵母的形态描述
将分离纯化的酵母接种到YPD培养基上,30 ℃培养2~3 d,在显微镜下观察酵母细胞形态和出芽情况。
1.3.3 酵母DNA的提取与PCR扩增[20]
取1.5 mL离心管,加入100 μL双蒸水,无菌条件下挑取酵母菌体于离心管中搅匀,将混合物充分涡旋,在8 000~10 000×g离心1 min。吸取上清液,加入100 μL重悬液,置于85 ℃下水浴40 min,然后置于-20 ℃下冷冻10 min,即得到DNA,以其为模板,采用真菌通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)及18S-P1(5′-CCAGGCTTTACACTTTATGC-3′)和18S-P2(5′-GCGATTAAGTTGGGTAACGC-3′)。PCR反应体系为Premix Taq 15 μL、DNA菌液2 μL、引物①0.5 μL、引物②0.5 μL,最后用双蒸水补充至30 μL。PCR反应程序为94 ℃预变性5 min,接下来35个循环包括94 ℃变性30 s,52 ℃退火50 s,72 ℃延伸1 min,最后一个循环在72 ℃延伸10 min。取5 μL PCR产物通过琼脂糖凝胶电泳检测条带有无,最后将含有目的条带的PCR原液送到武汉华大基因进行测序。将测序结果通过BioEdit软件进行剪切,并输入NCBI(美国国家生物技术信息中心)GenBank数据库进行同源性检索,获得近似序列。
1.3.4 菌种生理生化鉴定
对筛选酵母进行糖发酵实验、氮源同化实验、碳源同化实验、类淀粉实验、脲酶实验,参照文献[21]。
1.3.5 菌株耐受特性分析[22-23]
将活化后的菌株按2%(体积分数)的接种量(107 CFU/mL)接种于YPD液体培养基中,30 ℃培养2 d,用紫外分光光度计在600 nm处测定发酵液OD值。考察对象为葡萄糖质量浓度(0、50、100、150、200、250 g/L)、乙醇体积分数(3%、6%、9%、12%、15%)、pH(2.5、3.0、3.5、4.0、4.5)和温度(15、25、30、45、55 ℃)。
1.3.6 数据处理
使用Origin 2016对实验数据进行统计分析,Photoshop CS5对图片进行处理。
2 结果与分析
2.1 酵母的分子生物学鉴定
从酒曲酒醅中共分离出71株酵母,因7株菌在表观形态、微观形态相似,故共鉴定了64株,其中1株酵母(J-13)没有鉴定出。如表1所示,鉴定出的63株酵母分属于7个属13个不同种,分别为异常威克汉逊酵母(12株)、扣囊腹膜孢酵母(4株)、季也蒙毕赤酵母(1株)、库德里阿兹威毕赤酵母(17株)、发酵毕赤酵母(10株)、外岛毕赤酵母(1株)、膜醭毕赤酵母(1株)、酿酒酵母(10株)、白地霉(2株)(A.loubieri(1株)、T.loubieri(2株)、阿氏丝孢酵母(1株)和S.pararoseus(1株)),其中A.loubieri、T.loubieri和S.pararoseus首次在清香型白酒中发现。
表1 不同类型酵母鉴定结果
Table 1 Identification results of different types of yeast
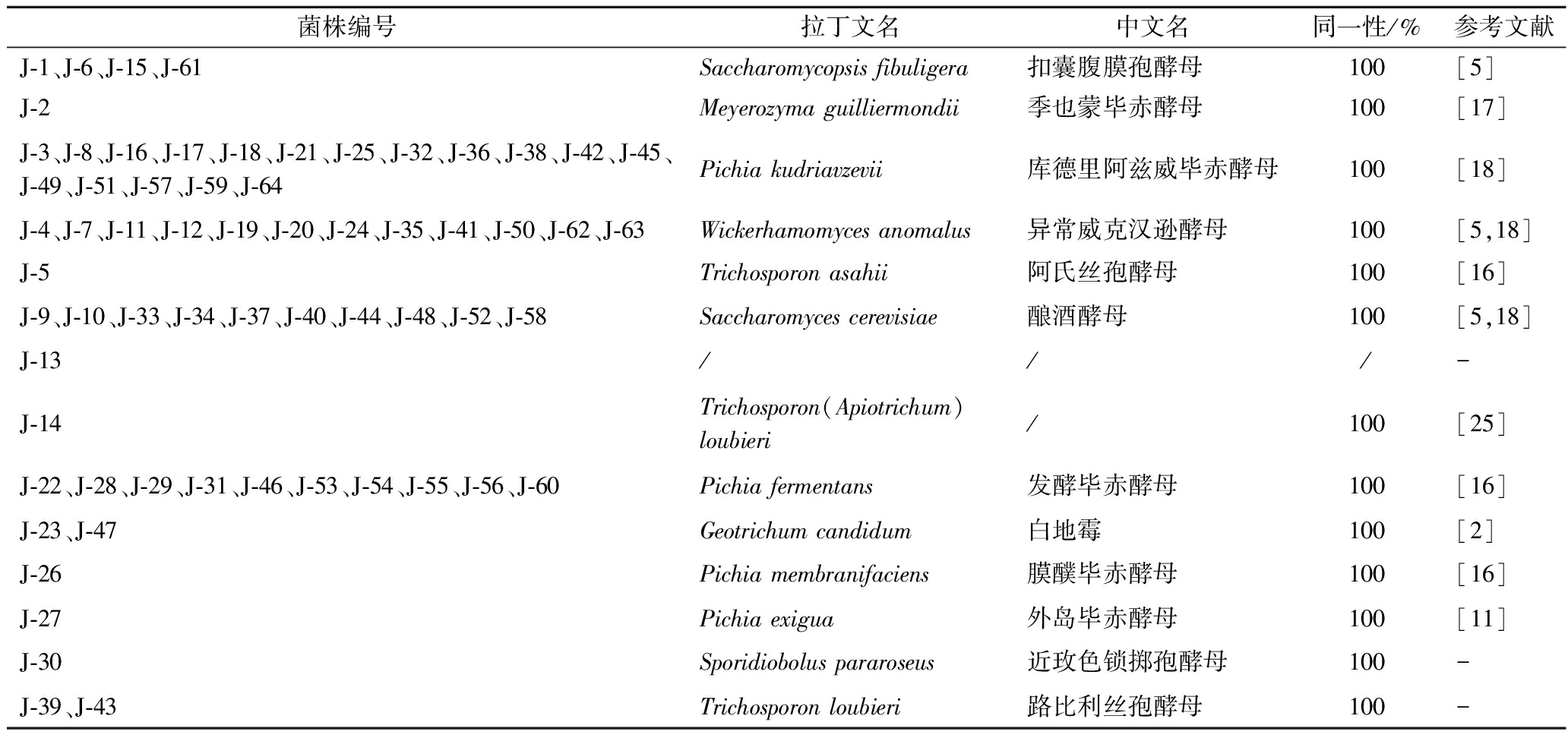
注:/,未鉴定成功;-,无参考文献对应
2.2 分离纯化的酵母在平板上的菌落形态特征
如图1所示,酿酒酵母呈乳白色圆形,有光泽,边缘整齐,显微下为圆球形。季也蒙毕赤酵母呈白色奶油状,平滑湿润有光泽,显微下为圆球形;发酵毕赤酵母呈乳白色无光泽,边缘不整齐,菌落凸起,有褶皱,单个酵母细胞为椭圆形;库德里阿兹威毕赤酵母菌落形态为奶油白色圆形,边缘呈齿蚀状,菌体凸起有褶皱,显微下为椭圆形;膜璞毕赤酵母为乳白色,边缘不整齐,菌落凸起有褶皱,单个酵母细胞呈梭形和卵圆形;外岛毕赤酵母为乳白色,边缘不整齐有短小绒毛,菌落凸起有褶皱,单个酵母细胞为卵圆形。这几类酵母在白酒风味物质形成中具有重要的作用[24]。异常威克汉逊酵母菌落呈奶油白色圆形,边缘环纹起皱,菌体黏稠,显微下为卵圆形和椭圆形;扣囊腹膜孢酵母菌落形态为白色圆形,质地呈短绒毛状,菌落边缘呈齿蚀状,显微下为卵圆形,有假菌丝和子囊孢子;白地霉呈奶白色圆形,表面绒毛状,生长直径可达2 cm左右,显微下能观察到横隔和节孢子,孢子形状为长筒形,末端钝圆。阿氏丝孢酵母、A.loubieri和T.loubieri均为丝孢酵母属下不同种。阿氏丝孢酵母为白色圆形,无光泽有凸起,呈脑回状,菌落边缘呈齿蚀状,显微下为圆形,长杆形、末端钝圆,有假丝和厚垣孢子;A.loubieri为淡黄色,菌落隆起无光泽,边缘整齐,单个细胞为球形或短矩圆形,有假菌丝。T.loubieri菌落早期为乳白色,菌体湿润,边缘不整齐,中间凸起,后期菌落渐渐变黄,菌体干燥,可见伸入培养基假菌丝,单个酵母细胞为圆球形,有假菌丝,并可见椭圆形和柱状的关节孢子。近玫色锁掷孢酵母呈橘红色圆形,光滑湿润,边缘整齐,显微形态为圆形和椭圆形。
2.3 酵母菌株生理生化实验
如表2所示,糖发酵结果表明大多数酵母均可发酵葡萄糖、蔗糖,或对葡萄糖、蔗糖有可变反应;能发酵麦芽糖的酵母占一半,仅扣囊腹膜孢酵母(J-6)发酵可溶性淀粉,T.loubieri(J-39)发酵乳糖和海藻糖;阿氏丝孢酵母(J-5)和膜璞毕赤酵母(J-26)均不发酵这6种糖类。氮源同化实验结果表明A.loubieri、T.loubieri、白地霉、膜璞毕赤酵母、扣囊腹膜孢酵母和发酵毕赤酵母对硝酸钠具有同化作用,其余酵母对硝酸盐不具有同化作用。脲酶实验结果表明发酵毕赤酵母和近玫色锁掷孢酵母为脲酶产生菌株,其余菌株为不产生脲酶菌株。类淀粉合成实验结果表明这13种酵母菌均不合成类淀粉。

A-酵母菌落;B-显微形态;A1-P.exigua菌落; A2-P.membranifaciens菌落
图1 13种不同酵母菌落和显微形态
Fig.1 Colonies and microscopic morphology of 13 different yeasts
表2 不同酵母生理生化实验结果
Table 2 Results of physiological and biochemical experiments of different yeasts
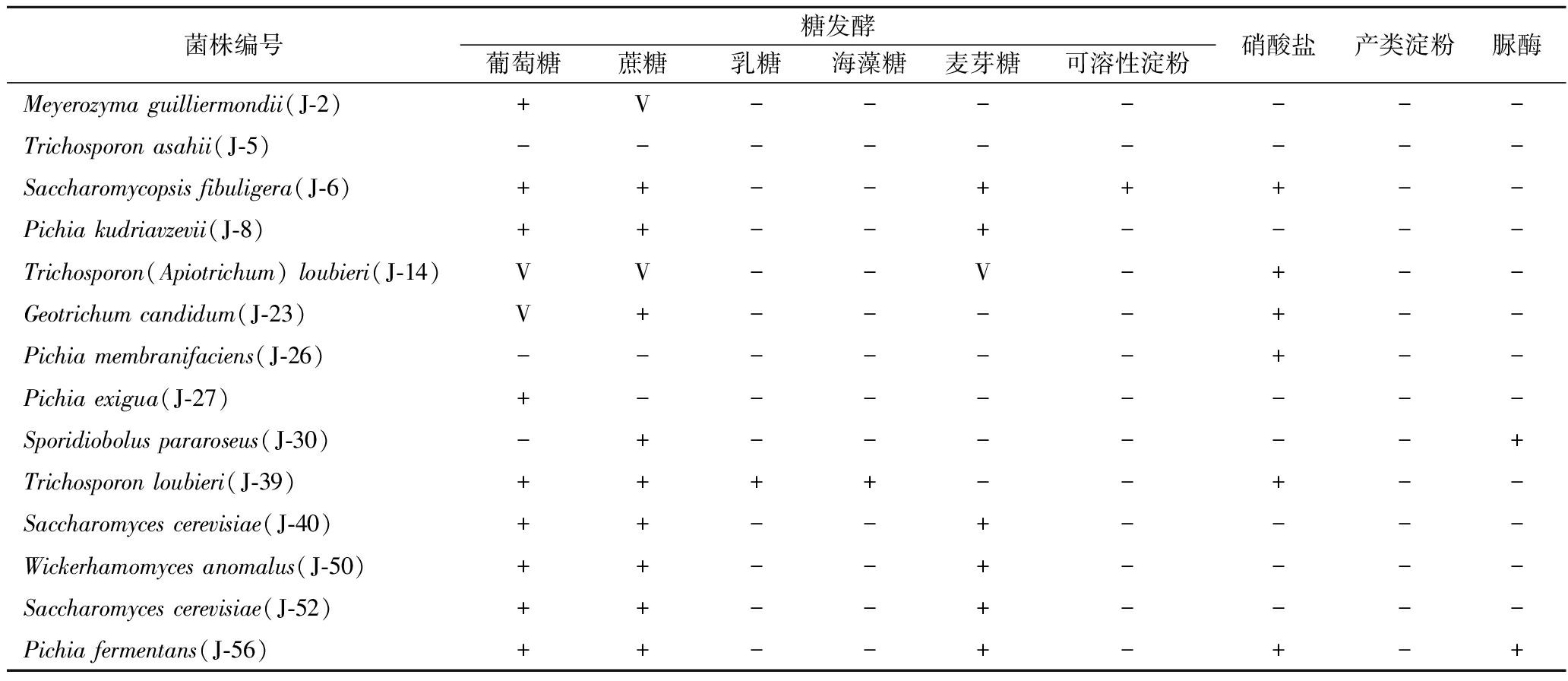
注:+表示阳性;-表示阴性;V表示可变反应,或阳性,或阴性
2.4 环境耐受性分析
2.4.1 耐高糖实验
如图2所示,酿酒酵母(J-52)、扣囊腹膜孢酵母(J-6)和T.loubieri(J-39)生物量随着糖浓度升高而增加,在最高糖质量浓度250 g/L下均可生长,说明此3株酵母葡萄糖耐受性最高;白地霉(J-23)和A.loubieri(J-14)菌株仅在葡萄糖含量低时生物量最高,说明其葡萄糖耐受性较差。
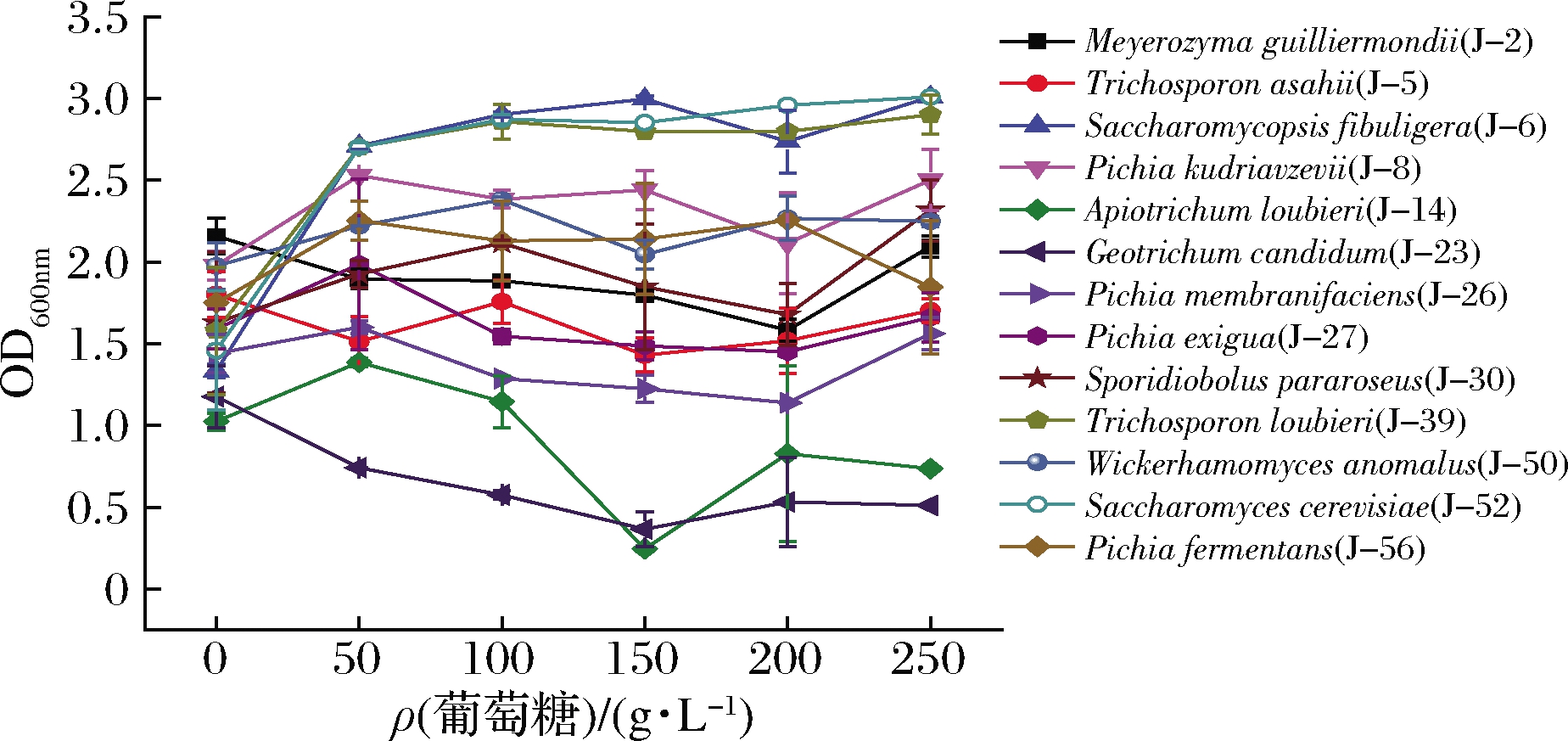
图2 葡萄糖含量对酵母生长的影响
Fig.2 Effect of glucose content on yeast growth
2.4.2 耐乙醇实验
如图3所示,所有酵母菌株随着乙醇含量增加生长均受到抑制,酵母生物量减少,相对来说,酿酒酵母(J-52)耐乙醇能力最强,在12%乙醇(体积分数,下同)下仍有一定的生长,扣囊腹膜孢酵母(J-6)和库德里阿兹威毕赤酵母(J-8)耐乙醇能力其次,在9%乙醇下仍生长较好。白地霉(J-23)和膜璞毕赤酵母(J-26)耐乙醇性最差,即使在最低乙醇3%时生长仍受到抑制。
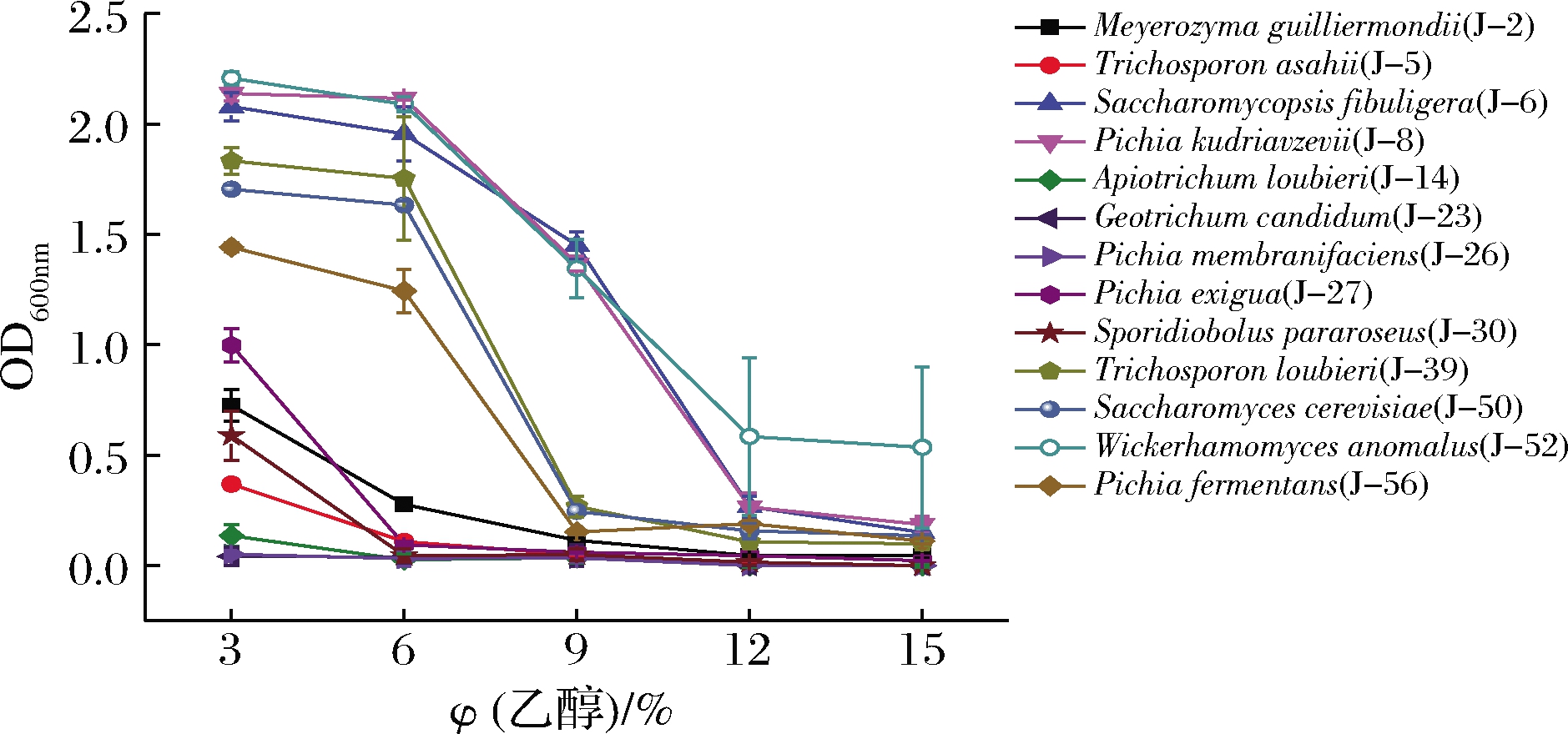
图3 乙醇含量对酵母生长的影响
Fig.3 Effect of alcohol content on yeast growth
2.4.3 耐pH实验
如图4所示,所有酵母菌株生物量随着pH增加而减少,酿酒酵母(J-52)、扣囊腹膜孢酵母(J-6)和库德里阿兹威毕赤酵母(J-8)生物量较高,耐酸性较强;膜璞毕赤酵母(J-26)生物量最低,耐酸性最差。
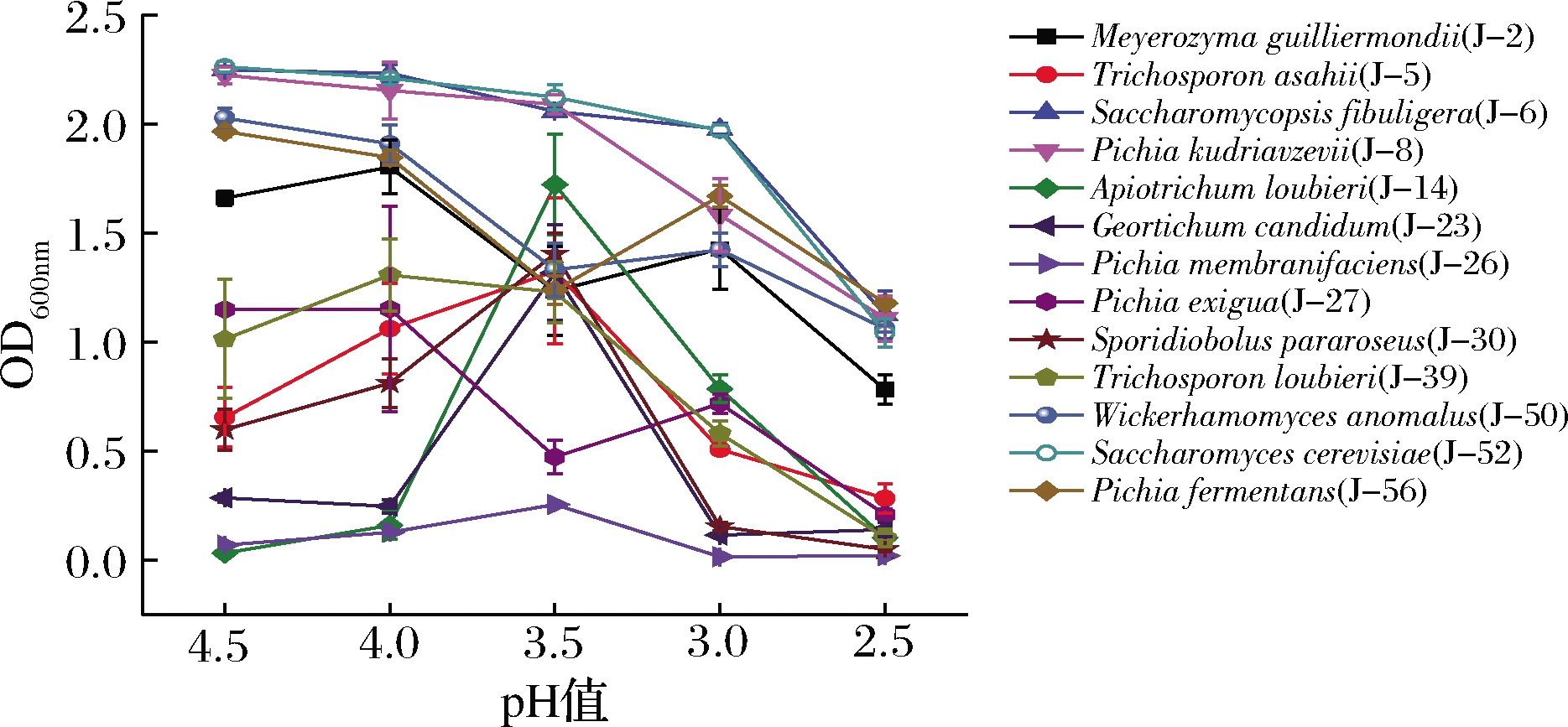
图4 pH对酵母生长的影响
Fig.4 Effect of pH on yeast growth
2.4.4 耐高温实验
如图5所示,所有酵母生物量随温度升高呈现先上升后下降趋势,其中T.loubieri和异常威克汉逊酵母在45 ℃具有最高生物量,说明这2株菌在45 ℃高温下能较好生长;与其它酵母菌株相比,库德里阿兹威毕赤酵母和酿酒酵母在55 ℃下仍具有较高生物量,表明它们耐高温性好。
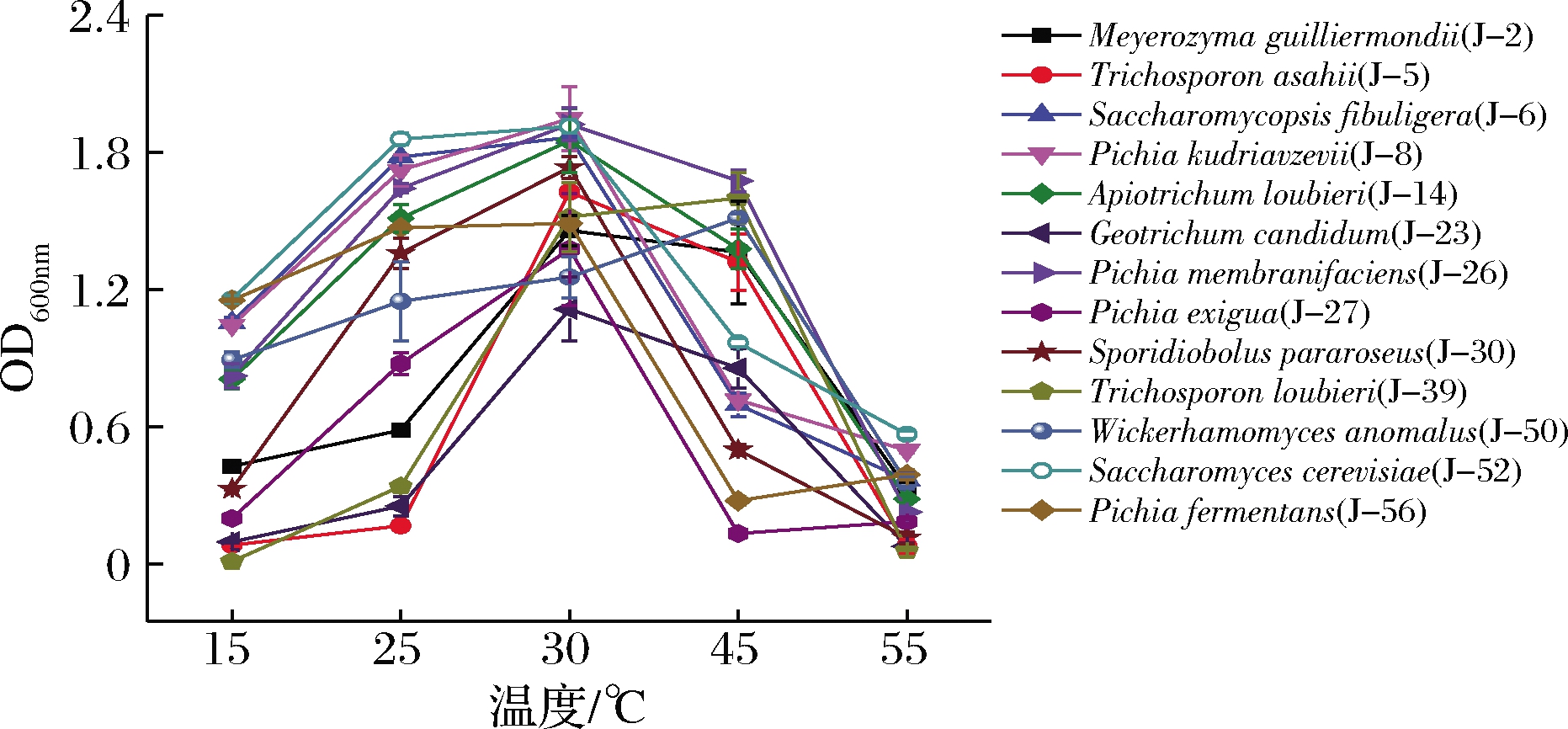
图5 培养温度对酵母生长的影响
Fig.5 Effect of temperature on yeast growth
3 结论
本研究通过经典分离法从劲牌公司酒曲和酒醅中获得了71株酵母,结合分子生物学技术鉴定了63株,分属于7个属13个种,从种类可以看出,多为酿酒酵母、异常威克汉逊酵母、库德里阿兹威毕赤酵母和发酵毕赤酵母。其中筛选得到的A.loubieri、T.loubieri和S.pararoseus是实验室菌种库前期未筛选到的,在清香型白酒中未见报道,通过资料查询发现此3种菌均存在于其他香型白酒酒曲中,对白酒风味形成具有贡献作用。有研究表明,T.loubieri为条件致病菌,但目前未见其在白酒酿造中致病的报道,未来有必要加大该菌在酿造中的生长代谢研究,明确其生物安全性。另外,经过生理特性研究,大多数酵母能发酵葡萄糖和蔗糖,A.loubieri、T.loubieri、白地霉、膜璞毕赤酵母、扣囊腹膜孢酵母和发酵毕赤酵母对NaNO3具有同化作用,发酵毕赤酵母和S.pararoseus为脲酶产生菌株,13种酵母均不能合成类淀粉。抗逆性研究表明,酿酒酵母(J-52)、扣囊腹膜孢酵母(J-6)、库德里阿兹威毕赤酵母(J-8)和T.loubieri(J-39)对高糖、高乙醇、高酸和高温具有良好的耐受性,具有广泛的应用前景。下一步将在清香型小曲白酒酿造工艺下对这13种酵母代谢产物及与其他菌株互作关系开展研究,探讨其对原酒质量影响,以期为清香型小曲白酒品质提升,提供优势菌株。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



