清香型白酒立醅期酒醅中主体酸和细菌菌群结构动态解析
白酒的常见香型主要包括:酱香型、浓香型、清香型等[1],其中清香型白酒因其“清蒸二次清”、地缸、固态分离发酵的工艺特点,“清字当头,一清到底”的工艺独特性,清、爽、绵、甜、净的质量典型性,养大楂、挤二楂的生产规律性,深受国内外消费者的喜爱。
白酒中的风味成分主要包括酸、酯、醇、醛和其他这五大类[2],其中有机酸是白酒重要的呈味物质,能起到呈香、助香、减少刺激和缓冲平衡的作用,其含量及相互比例直接影响着白酒的风味和质量[3-6]。清香型白酒中的主要酸为乳酸和乙酸[7-8],在清香型白酒的酿造过程中,缸内高粱经过蒸煮后发酵的固体粮食材料即为酒醅,酒醅经过蒸馏即可得到原酒,故清香型白酒酒醅中的乳酸、乙酸含量对清香型白酒的品质起着至关重要的作用。
立醅是生产过程中的第一道关口,立醅期是决定生产周期好坏的关键性因素。清香型大曲酒的立醅时间一般在9月份,此时气温、地温较高,再加上立醅时所用的全部是粮食,淀粉浓度高,酒醅升温快,来火猛,发酵快。若控制不当,容易造成酒醅酸败从而影响后续的发酵生产。并且由于酒醅中的淀粉酶和酵母仅适合于微酸性条件,所以酒醅中的酸度也不能过高,立醅期红糁入缸酸度一般在0.2左右。故监测立醅期大楂、二楂的主体酸含量变化情况对清香型白酒的生产有着十分重要的作用。
清香型酒醅中微生物组成十分复杂,主要包括细菌、霉菌和酵母菌,其中细菌菌群结构,尤其是乳酸菌菌群结构对酒体品质起着决定性作用。乳酸菌能利用可发酵碳水化合物产生大量乳酸[9],酒醅中乳酸的过量堆积会严重影响清香型白酒的口感,且酸度过大是固态发酵夏季掉排、出酒率降低的重要原因[10],故采用高通量测序技术分析酒醅中乳酸菌菌群结构,筛选出高产酸能力的乳酸菌种对清香型酒醅酿造有着重大的应用价值。
目前的研究主要集中于白酒中有机酸含量变化以及其他时期酒醅中菌群结构的变化,对于清香型白酒立醅期的酒醅鲜有研究。本文主要对清香型白酒立醅期酒醅样品中有机酸含量以及细菌菌群结构的变化进行分析。
1 材料与方法
1.1 材料
酒醅样品来源于山西杏花村汾酒厂有限公司。
在2020年9~11月的立醅期,跟踪汾七班组编号为1,2,3,4四个缸的发酵情况。不同发酵时间各有ABC三个平行样,具体取样时间如表1所示。取得的酒醅样品经液氮速冻后冻存于-80 ℃冰箱备用。
表1 取样时间
Table 1 Sampling time

1.2 主要试剂及仪器
乳酸、乙酸, Aladdin公司。
GelDoc EZ凝胶成像系统,美国 Bio-Rad 公司;Waters 2695高效液相色谱仪,美国Waters公司;UPH-IV-5/10/20T台上式超纯水仪,南京优普公司;PowerPac系列电泳仪,美国Bio-Rad公司;RC3BPPlus离心机,美国Thermo公司;5425 FA-24x2台式高速离心机,德国Eppendorf公司。
1.3 乳酸、乙酸含量的测定
酒醅样品处理:准确称取1.00 g发酵酒醅于10 mL离心管中,加入6 mL体积分数为50%的乙醇搅匀。在室温下浸泡30 min,在此期间每隔10 min搅拌一次,6 000 r/min 离心5 min;收集上清液,再往滤渣中加入3 mL体积分数为50%的乙醇溶液,再次离心并收集上清液;全部上清液定容于10 mL容量瓶得到液相检测样品,备用。
标准混合液的配制[11]:分别准确量取0.1 mL乳酸和乙酸的标准品,用体积分数为20%的乙醇色谱溶解并定容于100 mL容量瓶中,即得混合母液。分别量取0.5、1.0、2.0、3.0、4.0、5.0、6.0 mL标准混合母液用去离子水稀释、定容于10 mL容量瓶,得到8.0~650.0 mg/L不同浓度的混合标准液,备用。
流动相的配制:准确称取6.80 g KH2PO4,用去离子水溶解、定容于1 000 mL容量瓶,并用H3PO4调节pH至2.50,再经0.45 μm水相滤膜过滤、超声脱气30 min后使用;色谱级乙腈经0.22 μm有机滤膜过滤、超声脱气30 min后使用。
液相色谱条件:T13色谱柱;流动相V(乙腈)∶V(0.05 mol/L KH2PO4)=8∶92;流速1.0 mL/min;柱温30 ℃;进样量20 μL;检测波长210 nm。
1.4 酒醅微生物DNA的提取
首先称取10 g酒醅样品加入15~20 mL灭菌后的PBS,加入3颗玻璃珠,将50 mL离心管放置在振荡仪上振荡5 min,随后150×g离心5 min。再重复2次之前的步骤,每次加5~10 mL的PBS,振荡仪可改成手摇。缓慢倾倒收集上清液,用PBS精确配平后10 000 r/min离心10 min,往样品中加入PBS多次吹吸,收集沉淀至5 mL管中,大颗粒尽量留在原管中。随后10 000 r/min离心10 min。最后往得到的沉淀中加入500 μL PBS混悬,接着反复冻融3次,液氮30 s,70 ℃水浴2 min。往离心管中先加5 μL溶壁酶,30 ℃水浴1 h;接着加2 μL溶菌酶,37 ℃水浴30 min;随后加5 μL RNA酶,37 ℃水浴1 h;最后加2.5 μL蛋白酶K,65 ℃水浴30 min。采用QIAGEN试剂盒提取,利用琼脂糖电泳对提取的微生物DNA进行质量检测,合格后进行建库、测序。
1.5 高通量测序及数据分析
建库与测序由武汉华大基因公司完成。取质量合格的基因组DNA样品30 ng及对应的融合引物配置PCR反应体系,设置PCR反应参数进行PCR扩增,使用Agencourt AMPure XP磁珠对PCR扩增产物进行纯化并溶于Elution Buffer,贴上标签,完成建库。使用Agilent 2100 Bioanalyzer 对文库的片段范围及浓度进行检测。检测合格的文库根据插入片段大小,选择HiSeq平台进行测序。下机数据过滤,剩余高质量的Clean data用于后期分析;通过reads之间的overlap关系将reads拼接成Tags;将Tags聚类成OTU并与数据库比对、物种注释;基于OTU和注释结果进行样品物种复杂度分析,组间物种差异分析,以及关联分析与模型预测等。对原始的测序数据进行处理,获得Clean Data。OTU聚类有2种方法,Usearch和DADA2。如果聚类方法用的是Usearch,要用这里的tag直接进行OTU聚类,序列拼接使用软件 FLASH(Fast Length Adjustment of Short reads),利用重叠关系将双末端测序得到的成对reads组装成一条序列,得到高变区的Tags。对OTU聚类结果进行统计,得到OTU代表序列后,通过RDP classifer软件将OTU代表序列与数据库有比对进行物种注释,置信度阈值设置为0.6。比对数据库对注释结果进行过滤,剩余的OTU可用于后期分析。
1.6 产乳酸关键微生物的筛选及鉴定
首先用稀盐酸调节MRS琼脂培养基pH至6.0,接着在灭菌后,凝固前液体状态的培养基中加入质量浓度为8 μg/mL的两性霉素以抑制真菌的生长。用分析天平称取8 mg的两性霉素,置于超净台中紫外灭菌15 min,接着往两性霉素中加入1 mL DMSO混匀后用1.5 mL的离心管分装,配成8 mg/mL溶液。使用时,往培养基中加入0.1%的量。最后往灭菌后的液态培养基中加一定量的溴甲酚绿作为乳酸菌产酸的指示剂,取0.1 g溴甲酚绿溶于5 mL DMSO中,最后将配好的溶液加入至1 L培养基中。
准确称取10.0 g酒醅于含玻璃珠的灭菌后的100 mL PBS中,室温振荡20~30 min混合,静置后取上清液1 mL置于9 mL无菌水试管中,得到10-1的稀释液,以此类推,依次制成10-2、10-3、10-4、10-5、10-6、10-7的稀释样液。吸取0.1 mL梯度稀释液均匀涂布于培养基平板上,同一稀释梯度涂2个板,置于37 ℃培养箱中培养96~120 h,刚开始培养时每隔4 h观察一次菌落颜色是否变绿,及时将变绿菌落标记出来。
根据稀释涂布平板上的单菌落特征,挑取变色菌落中形态不同的菌株在MRS平板上划线纯化3~4次,得到单菌落后接种于液体培养基中,37 ℃培养一定时间后保藏在甘油管中-20 ℃备用。采用分子生物学的鉴定方法对菌株进行鉴定[12-13]。
1.7 产乳酸关键微生物的产酸能力验证
将筛选所得菌株与16S扩增子测序的种水平数据结果进行比对,选出占比较大的菌株。将这些菌株在MRS培养基中进行液体培养,活化后接种500 μL至50 mL MRS液体培养基中,各菌株接种3个平行,37 ℃下静置培养,前两天每隔12 h取样,后期每隔24 h取样,检测各菌株在发酵过程中的pH下降速率,采用HPLC技术检测发酵趋于稳定时发酵液中的乳酸、乙酸、柠檬酸、琥珀酸、苹果酸等含量,用以评估各菌株的产酸能力,挑选出产酸能力最强的菌株。
1.8 产乳酸关键微生物的耐酸、醇能力验证
耐酸性实验:已知酒醅环境pH值为3.5~4.5。将灭菌的MRS培养基用乳酸调节培养基pH分别为2.5、3.0、3.5、4.0、4.5、5.0,将活化好的菌株按体积比1%的接种量分别接入调节pH后的MRS培养基中,每个梯度3个平行,于37 ℃恒温培养24 h,以未接菌的MRS培养基为对照,用酶标仪测定其吸光度[14]以得出该菌的耐酸能力。
耐醇性实验:设置体积分数为2%、4%、6%、8%、10%乙醇梯度的MRS培养基,将活化好的菌株按体积比1%的接种量分别接入调节pH后的MRS培养基中,每个梯度3个平行, 37 ℃恒温培养24 h,以未接菌的MRS培养基为对照,用酶标仪测定其吸光度得出该菌的耐酸能力
2 结果与分析
2.1 酒醅发酵过程中主要有机酸的变化情况
在清香型白酒酒醅发酵过程中,酒醅中的有机酸以乳酸含量最高,占支配地位,乙酸含量次之[15],故乳酸、乙酸是构成酒体风味的主要有机酸,立醅期酒醅中适当的酸含量对后续清香型白酒生产有着十分重要的作用。对清香型白酒大楂、二楂在不同发酵阶段的乳酸、乙酸变化情况进行分析发现,在大楂发酵阶段,发酵初期0~7 d乳酸含量逐渐升高,7 d后至出缸时乳酸含量无显著变化,逐渐趋于平稳(图1-a);乙酸则在发酵初期0~15 d显著增加,15 d之后增长速率放缓(图1-b)。
在二楂发酵阶段,乳酸、乙酸的初始含量与酒醅大楂时期出缸时的主体酸含量基本一致,这说明大楂出缸时蒸馏酒醅的步骤对有机酸的损失影响较小,这与清香型白酒生产过程的实际情况相一致。乳酸在发酵初期0~15 d含量逐渐增加但增长速率减缓,15 d至出缸时乳酸含量缓慢下降(图1-c);乙酸变化情况与大楂时相似,从整体上看入缸至出缸时酒醅中乙酸含量处于上升状态,发酵初期0~4 d乙酸含量增长速率较高,4~22 d乙酸增长速率放缓,22 d至出缸时乙酸增长速率又显著提高(图1-d)。
立醅期大楂酒醅中的乳酸含量为3.20~7.74 g/L,乙酸为0.58~0.93 g/L;二楂酒醅中乳酸含量为7.85~13.9 g/L,乙酸含量为0.86 ~1.43 g/L,由此可知二楂酒醅中的主体酸含量显著高于大楂酒醅,这是因为在进行二楂蒸馏时,会再一次添加辅料,二楂酒醅与大楂时相比更为疏松,且此时酒醅中已含有大楂发酵阶段产生的各种代谢物质,所以二楂阶段微生物迅速繁殖,升温提前[16],同时由于二楂混料时曲细,水分大,入缸温度高,高温时间显著早于大楂。高温及二楂的混料工艺适合产酸细菌的生长,因此二楂酒主体酸含量显著高于大楂酒[17]。
由乳酸、乙酸含量变化范围也可知立醅期酒醅中的乳酸含量远远高于乙酸含量,从图2可知,大楂酒醅中乳酸与乙酸之比在5.53~9.93,在发酵初期(0~4 d)乳酸与乙酸比值显著升高,4~15 d乳酸与乙酸比值逐渐降低,15 d之后乳酸乙酸比值趋于平稳;二楂酒醅中乳酸与乙酸之比为8.62~11.48,在发酵初期0~15 d乳酸与乙酸比值逐渐升高,发酵后期15 d至出缸时乳酸与乙酸比值显著降低,这与乳酸变化情况基本一致。综上所述,除二楂酒醅中的主体酸含量高于大楂酒醅外,二楂酒醅乳酸与乙酸的比值也始终高于大楂酒醅。
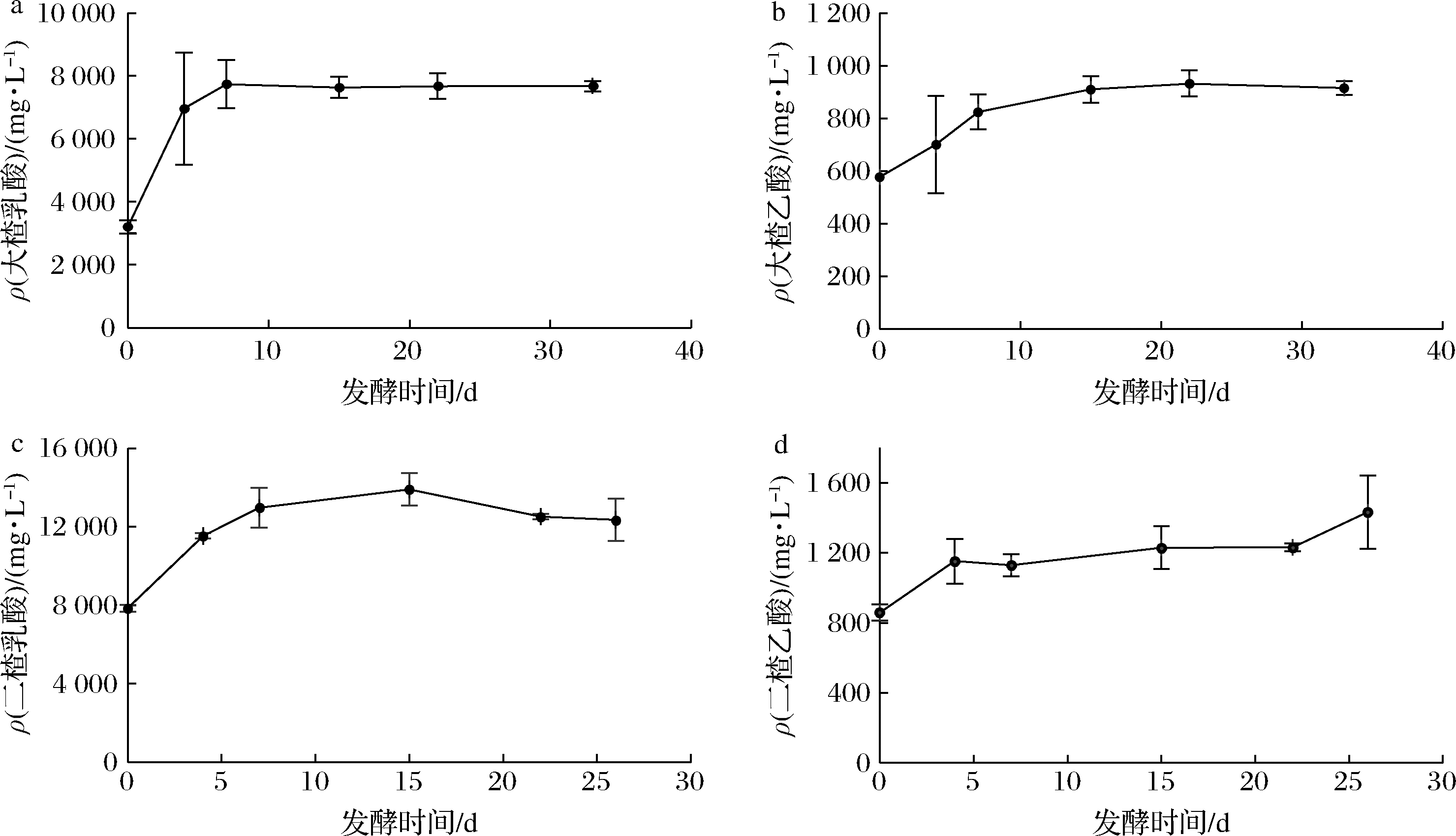
a-大楂乳酸浓度;b-大楂乙酸浓度;c-二楂乳酸浓度;d-二楂乙酸浓度
图1 大楂、二楂酒醅发酵过程中乳酸、乙酸变化情况
Fig.1 Change of lactic acid, acetic acid in fermented grains of Dacha and Ercha
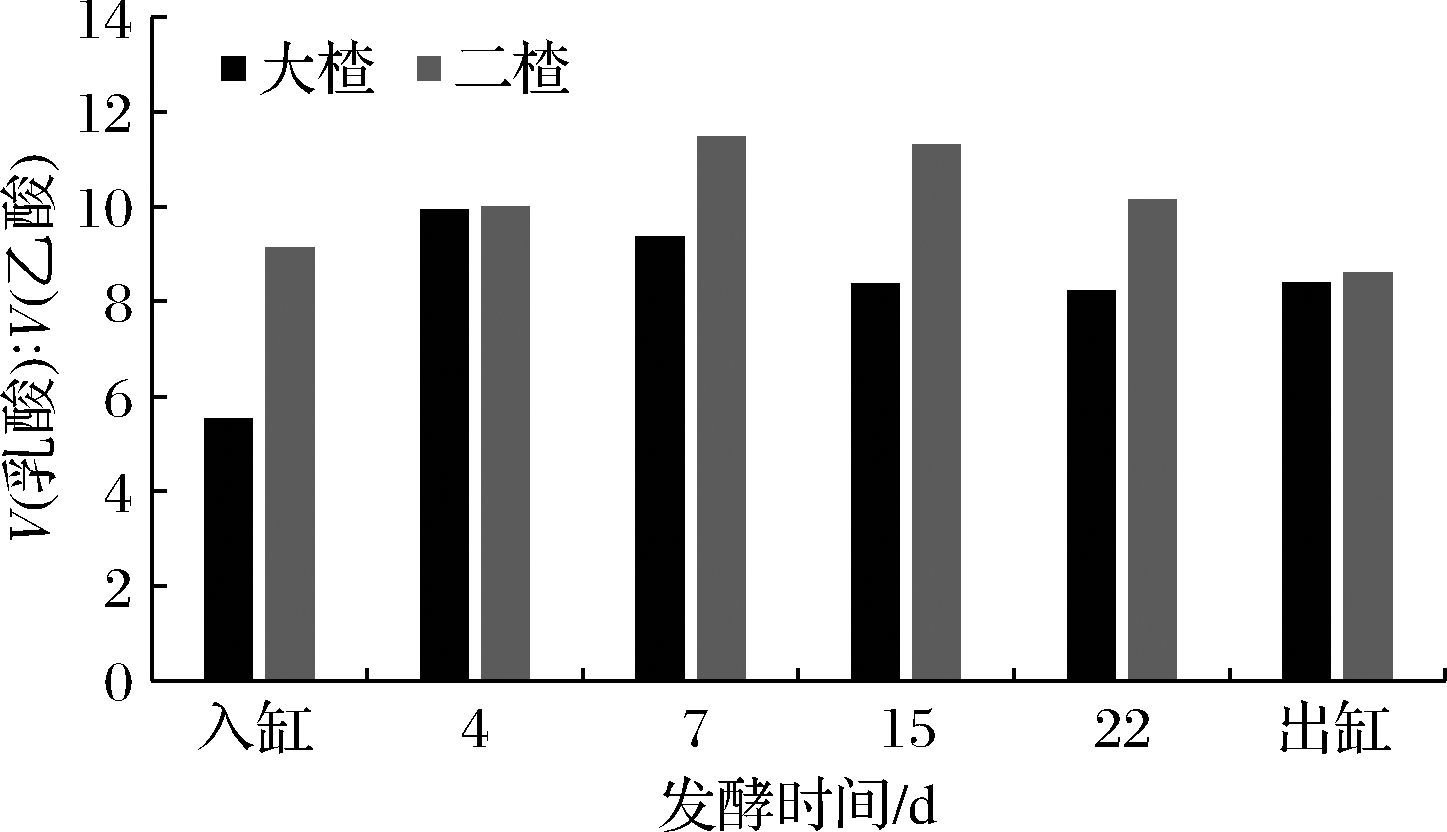
图2 酒醅发酵过程中乳酸与乙酸含量比例的变化情况
Fig.2 Change in the ratio of lactic acid to acetic acid during the fermentation of fermented grains
2.2 酒醅发酵过程中细菌菌群结构分析及其变化规律
乳酸菌能利用可发酵碳水化合物产生大量乳酸[9],酒醅中酸类物质的产生主要是不同微生物作用的结果。为了进一步认识清香型酒醅中微生物随时间的变化规律,对不同发酵时间大楂和二楂阶段的酒醅微生物菌群结构进行分析。从酒醅16S扩增子测序结果可以看出,立醅期发酵过程中的主要细菌门类包括厚壁菌门(Firmicutes)、蓝藻门(Cyanobacteria)、变形菌门(Proteobacteria)、放线菌门(Actinobacteria)、拟杆菌门(Bacteroidetes),其中厚壁菌门在酒醅样品中的占比最高,在清香型酒醅发酵过程中始终处于优势地位[18]。
进一步从属水平对立醅期酒醅发酵过程中的细菌群落结构进行分析,所有酒醅样品中丰度较高的菌种有13种,包括:泛菌属(Pantoea)、克罗彭施泰特氏菌属(Kroppenstedtia)、葡萄球菌属(Staphylococcus)、乳杆菌属(Lactobacillus)、链霉菌属(Streptomyces)、醋酸杆菌属(Acetobacter)、明串珠菌属(Leuconostoc)、片球菌属(Pediococcus)、糖多孢菌属(Saccharopolyspora)、普氏菌属(Prevotella)、GPI、魏斯氏菌属(Weissella)、拟杆菌属(Bacteroides)。
其中厚壁菌门下的乳杆菌属在整个发酵过程中始终占有绝对的优势,故乳酸菌的代谢产物乳酸的含量在发酵过程中始终处于高位。随着发酵时间的延长,在大楂(DX)酒醅样品发酵初期0~7 d过程中乳杆菌属的相对丰度明显升高,发酵后期至出缸时(D33)的乳杆菌属相对丰度趋于平稳,这与之前所述乳酸含量在发酵初期含量显著上升,7 d后乳酸含量几乎无明显波动的变化情况基本一致。而二楂(EX)酒醅样品在发酵后期15 d后的乳杆菌属相对丰度高达96%,这与之前所述二楂发酵过程中乳酸含量在15 d后增加也相一致(图3)。除此之外可以明显的看出乳杆菌属在各对时酒醅中相对丰度较大,尤其在发酵后期菌种数量显著升高,故后续乳酸菌的筛选可集中在发酵后期的样品上。
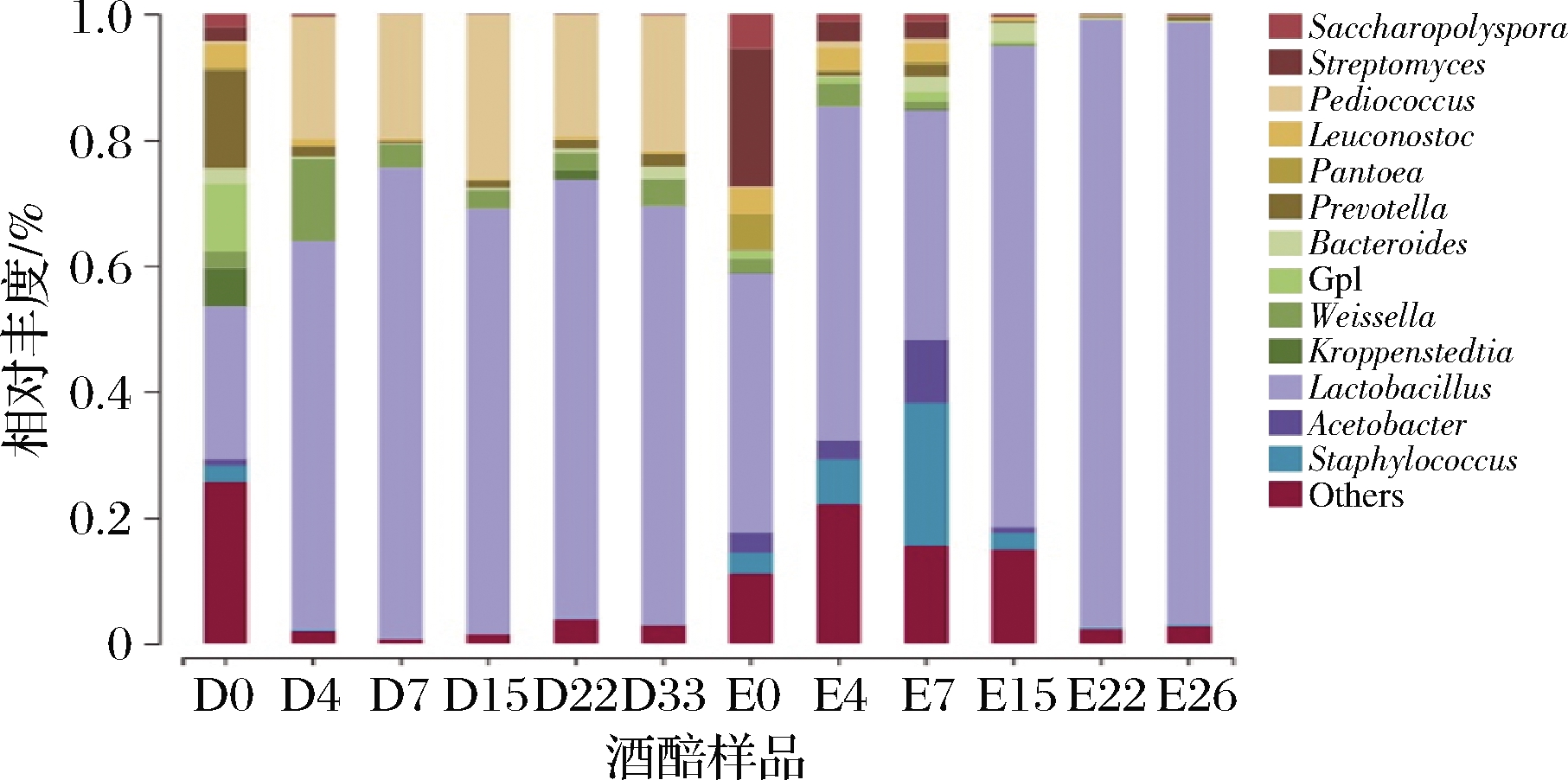
图3 细菌菌群结构发酵期间属水平丰度变化
Fig.3 Change in bacterial flora structure during the fermentation at genus level
进而从种水平对立醅期酒醅发酵过程中的菌种进行动态解析,由16S扩增子测序原始数据可知,立醅期酒醅样品中共有16个优势菌种,包括:类肠膜魏斯氏菌(Weissella paramesenteroides)、旧金山乳杆菌(Lactobacillus sanfranciscensis)、直杆糖多孢菌(Saccharopolyspora rectivirgula)、类食品乳杆菌(Lactobacillus paralimentarius)、Kroppenstedtia eburnea、仁果枝孢醋酸杆菌(Acetobacter malorum)、索里魏氏菌(Weissella soli)、耐酸乳杆菌(Lactobacillus acetotolerans)、棒状腐败乳杆菌(Lactobacillus coryniformis)、Pantoea vagans、植物乳杆菌(Lactobacillus plantarum)、普氏菌(Prevotella copri)、白色链霉菌(Streptomyces albus)、小片球菌(Pediococcus parvulus)、食二酸乳杆菌(Lactobacillus diolivorans)、柠檬色明串珠菌(Leuconostoc citreum)。
其中在12种产乳酸微生物中,旧金山乳杆菌能很好地利用面粉中的主要糖类麦芽糖,对馒头的风味和质构有重要的影响[19];类食品乳杆菌利用葡萄糖发酵产酸但不产气,多用于面制品发酵;耐酸乳杆菌可发酵果糖、半乳糖、葡萄糖和核糖;类肠膜魏斯氏菌可发酵葡萄糖产乳酸;索里魏氏菌是一种从土壤中分离出来的乳酸菌[20];棒状腐败乳杆菌、植物乳杆菌、食二酸乳杆菌均为乳杆菌属,故均可产乳酸。Pantoea vagans属于泛菌属,可发酵葡萄糖产乳酸;小片球菌属于片球菌属,会利用葡萄糖发酵产酸但不产气;柠檬色明串珠菌利用葡萄糖发酵产酸产气,常用于生产酸奶、奶酪辅发酵剂。普氏菌采用溴甲酚紫作为产酸指示剂进行筛选[21]。产乙酸微生物仁果枝孢醋酸杆菌能将糖类和酒精氧化成醋酸等产物。
由图4可知,各菌种随着发酵的进行呈现出不规则的动态变化(图4)。在酒醅大楂发酵时期,植物乳杆菌的相对丰度占比最大,且波动较大,大楂0~7 d逐渐上升,7~33 d显著下降,二楂0~4 d相对丰度逐渐升高,4 d之后该菌株占比整体有呈现下降趋势;在酒醅二楂发酵时期,耐酸乳杆菌从二楂15 d开始该菌株相对丰度显著升高,二楂15~26 d该菌株呈现上升趋势,在22 d相对丰度高达95.49%。食二酸乳杆菌在大楂发酵阶段相对丰度逐渐增加,特别是大楂发酵后期15~33 d该菌株在酒醅样品占比最大,在二楂发酵阶段该菌株相对丰度整体呈下降趋势。棒状腐败乳杆菌的相对丰度在大楂0~4 d逐渐升高,4~33 d该菌株相对丰度降低且趋势逐渐平稳,二楂阶段该菌株相对丰度较低。仁果枝孢醋酸杆菌在二楂发酵前期0~7 d相对丰度占比较大且逐渐上升,7 d之后该菌株占比骤减。
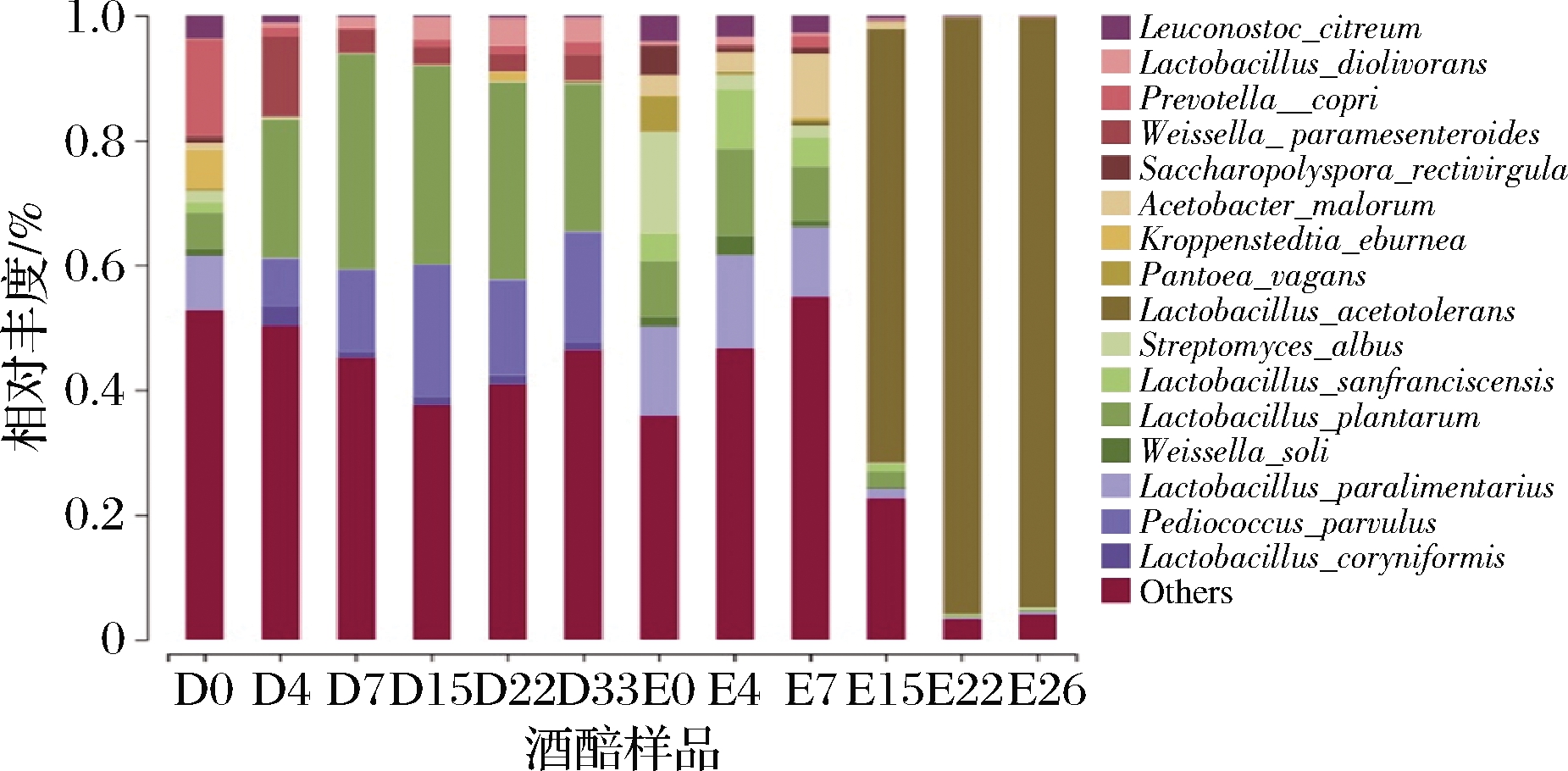
图4 细菌菌群结构发酵期间种水平丰度变化
Fig.4 Change in bacterial flora structure during the fermentation at species level
结合2.1中图1的相关分析可知,立醅期酒醅主体酸含量与菌落结构密切相关,其中在大楂发酵阶段植物乳杆菌相对丰度随发酵时间的变化与乳酸含量变化呈正相关,在二楂发酵阶段耐酸乳杆菌相对丰度随发酵时间的变化与乳酸含量变化呈正相关,仁果枝孢醋酸杆菌与二楂后期酒醅中乙酸含量的升高有关。故植物乳杆菌、耐酸乳杆菌是影响酒醅发酵过程中乳酸产量的关键菌株,仁果枝孢醋酸杆菌是影响酒醅发酵过程中乙酸产量的关键菌株。
2.3 MRS培养基分离筛选清香型酒醅中的产乳酸微生物
为了进一步确定清香型白酒立醅期发酵体系中的产乳酸优势菌种,采用MRS培养基对发酵后期酒醅样品中的产乳酸微生物进行分离纯化。
根据高通量测序结果可知,立醅期酒醅样品中主要有16个相对丰度较高的优势菌种。将筛选得的产乳酸微生物进行分子生物学鉴定,分离得到的菌株主要包括:植物乳杆菌Lactobacillus plantarum(LP)、棒状腐败乳杆菌Lactobacillus coryniformis(LC)、食二酸乳杆菌Lactobacillus diolivorans(LD)、嗜酸片球菌Pediococcus acidilactici(PA)、利维短乳杆菌Levilactobacillus brevis(LB)。其中分离得到3株相对丰度较高的优势菌种,包括:L.plantarum、L.coryniformis、L.diolivorans,各菌株在酒醅样品中的相对丰度占比分别是:L.plantarum在大楂酒醅样品中占比25.42%,在二楂酒醅样品中占比5.57%;L.coryniformis在大楂酒醅样品中占比1.36%,在二楂酒醅样品中占比0.004 8%;L.diolivorans在大楂酒醅样品中占比2.44%,在二楂酒醅样品中占比0.39%(图5)。而P.acidilactici和L.brevis可能由于丰度过小,在图5中并未找到这2株菌。还有部分高丰度菌株(耐酸乳杆菌Lactobacillus acetotolerans等)未筛选到,可能是由于这些厌氧菌株需要在严格的无氧环境下才能筛选得到。
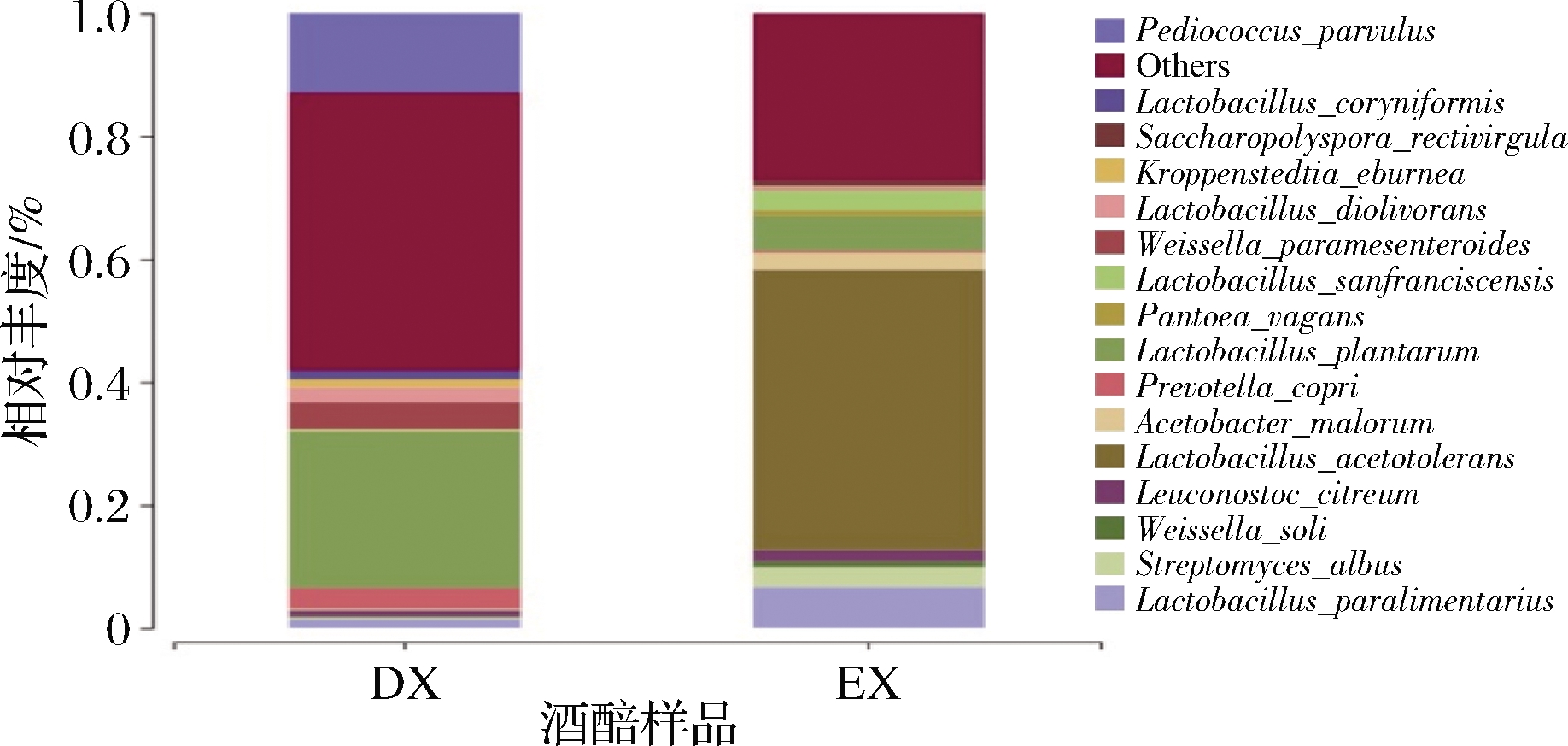
图5 大楂和二楂酒醅中细菌种水平占比情况
Fig.5 Proportion of bacterial species level in fermented grains of Dacha and Ercha
2.4 优势产乳酸微生物产酸、耐酸、耐醇能力验证分析
由2.2的相关分析可知,菌株的相对丰度变化与酒醅中主体酸含量相关,因此对立醅期发酵阶段筛选出的5种产乳酸微生物进行产酸能力验证分析(图6)。
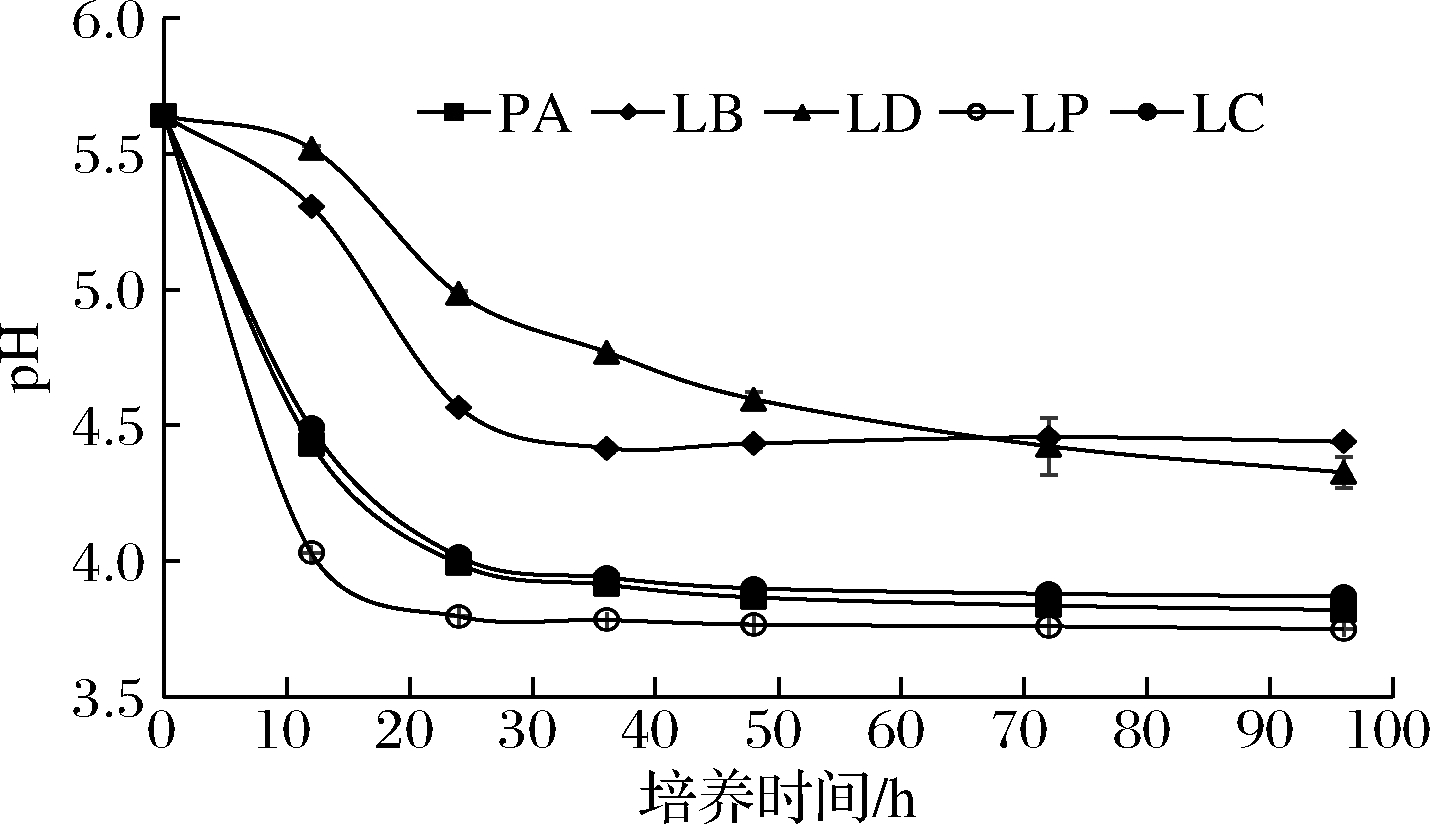
图6 各菌株发酵液中pH随时间的变化情况
Fig.6 Variation of pH in fermentation broth of strains with time
由图6可知,菌株LP在发酵过程中的pH下降速率最快,且发酵稳定时发酵液pH达到3.9,故菌株LP的产酸能力最强,这与菌株LP是酒醅发酵前期产乳酸关键菌株的结论相一致。菌株LC、菌株PA的pH下降速率以及稳定期时发酵液pH值仅次于菌株LP。
对产乳酸微生物的耐酸、耐醇能力进行验证分析:菌株LD在pH 4时OD600值为0.589,pH 3.5时OD600值为0.528,远高于另外4株菌的吸光度,说明其耐酸能力较强。菌株LC pH 4.5时,其OD600已降至0.721,略低于其他菌株,说明其在pH 4.5时耐酸能力较弱。但这5株菌株均可耐受pH 2.5时的发酵环境(图7)。
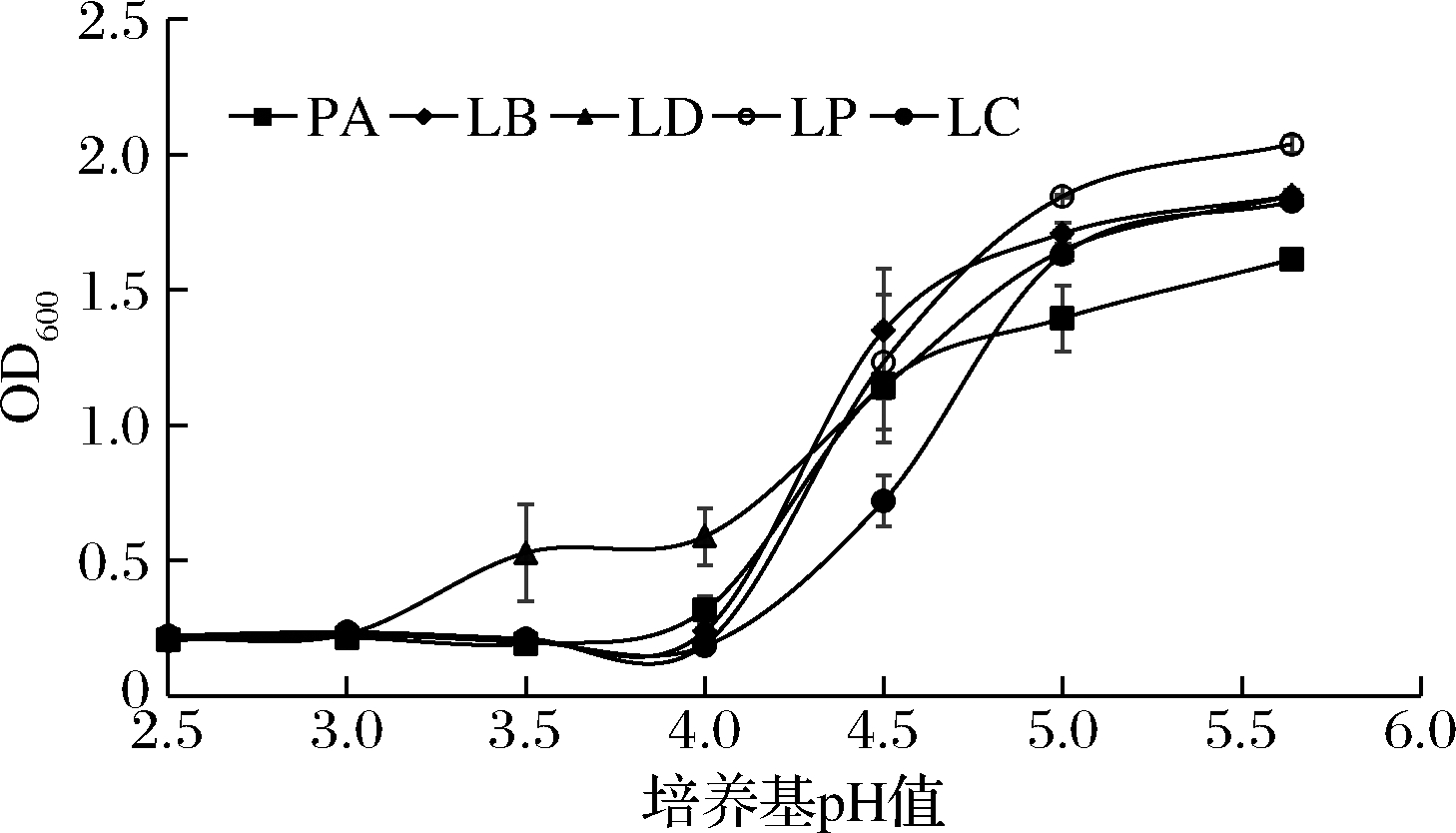
图7 各菌株耐酸能力特性
Fig.7 Acid resistance of strains
菌株LP在乙醇体积分数6%时OD600值下降至0.771,远低于其他菌株,说明其耐醇能力最弱;菌株LC在乙醇体积分数10%时OD600值高达1.35,说明其耐醇能力最强(图8)。
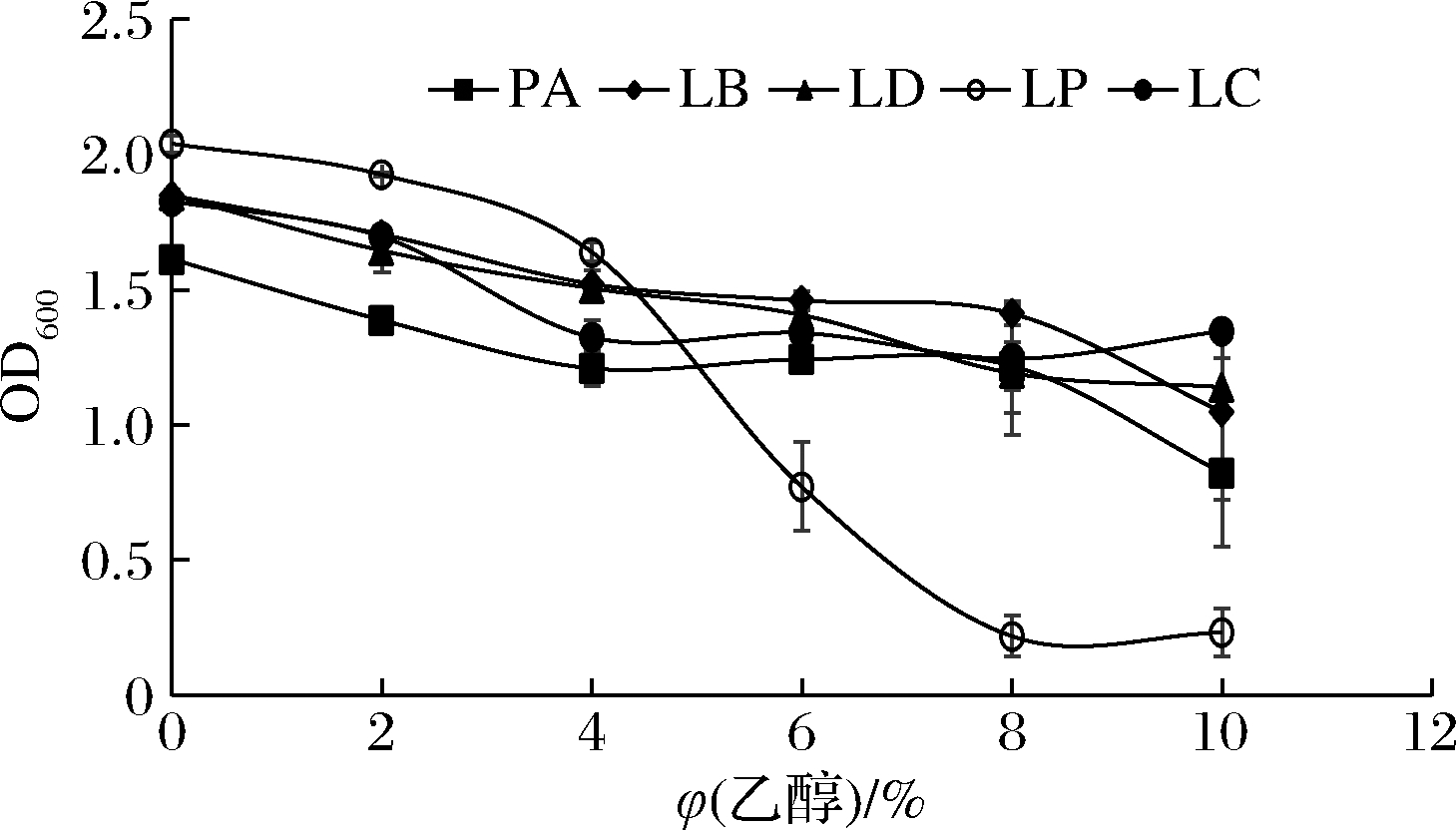
图8 各菌株耐醇能力特性
Fig.8 Alcohol resistance of strains
各菌株的发酵特性分别为:菌株LP产酸能力最强,可以耐受pH 2.5的酸环境,但耐醇能力最弱;菌株LC产酸能力较强,耐醇能力也最强,虽然也能耐受pH 2.5的酸环境,但在pH 4.5的酸环境下OD600值较低;菌株PA产酸能力较强,可以耐受pH 2.5的酸环境,也可以耐受体积分数10%的乙醇环境;菌株LD可耐受pH 2.5的酸环境且酸耐受性最强,可耐受体积分数为10%的乙醇,但产酸能力最弱;菌株LB产酸能力较弱,但耐酸醇能力较强。总而言之,棒状腐败乳杆菌LC和嗜酸片球菌PA具有较强的产酸能力和耐酸、耐醇能力,对改善清香型白酒的风味口感有着潜在的应用价值。
3 结论
本研究对立醅期清香型白酒发酵过程中主体酸含量的变化规律,以及酒醅中细菌菌群结构变化情况进行分析,进而从发酵后期的酒醅样品中筛选得到具有较强产酸、耐酸、耐醇能力的菌株:棒状腐败乳杆菌Lactobacillus coryniformis和嗜酸片球菌Pediococcus acidilactici。这为之后的微生物代谢改造提供了基本的信息,筛选出的菌株也对改善清香型白酒的风味口感具有潜在应用价值。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



