一株降解氨基甲酸乙酯酿酒酵母菌的筛选及鉴定
氨基甲酸乙酯(ethyl carbamate,EC),存在于许多发酵食品和发酵饮料中[1],由含氮化合物不完全代谢产生[2],该物质于2007年被国际癌症研究机构从2B类提升至2A类致癌物[3]。许多发达国家对市场上各类酒精饮品中的EC含量出台了限量标准[4],由于人们对酒精饮料的广泛摄入,其中EC带来的问题愈来愈受到人们的关注。
葡萄酒中的EC主要由尿素和瓜氨酸与乙醇反应生成,分离筛选低产EC或降解EC及其前体物质尿素的菌株[5-7],从源头上控制EC是一条方便快捷且行之有效的途径。近年来,国内外学者对降低发酵产品中EC的研究主要聚焦在筛选具有降解EC能力的菌株上,并进一步研究所筛选菌株产生的EC水解酶的相关特性。KOBASHI等[8]首次从小鼠粪便中分离出1株柠檬酸杆菌,发现该菌可将氨甲酸乙酯分解为乙醇和氨,并将具有这种降解能力的酶命名为urethanase。MOHAPATRA等[9]从海绵体螺旋藻中分离出有EC降解能力的微球菌,并初步研究了EC水解酶的特性;赵雅敏[5]从白酒大曲中筛选出1株具有EC降解能力的红酵母,并通过固定化细胞的方法使得该菌对黄酒酒样中EC的去除率从5%提高到了50%;杨广明[10]从小鼠消化系统中筛选出1株对EC和尿素都有相对较强的降解作用的菌株,鉴定为Providencia sp.,并对酶的性质做了初步研究;姚晓瑞宁[11]从香梨和葡萄中筛选出1株可以有效降解EC的鲁考弗梅奇属酵母;丁霞等[6]从浓香型白酒酒醅中分离得到1株能够同时降低 EC 及其前体尿素的解淀粉芽孢杆菌。
目前可产生EC水解酶的菌株,对降低酒精饮料中的EC含量具有较强的能力,但菌株本身不可直接用于葡萄酒的酿造。因此,本研究以筛选1株发酵葡萄酒性能良好且可降解EC的酵母菌为目标,从酿酒葡萄、干化葡萄和白酒酒醅中分离数株有EC降解能力的酵母菌,并对这些菌株进行发酵性能考察,以期为控制葡萄酒中EC含量提供参考。
1 材料与方法
1.1 材料
酿酒葡萄:宁夏银川贺兰县宁夏园艺产业园种植的多个酿酒葡萄品种;干化葡萄:宁夏吴忠青铜峡产区2019年赤霞珠,经干化处理;白酒酒醅:宁夏食品微生物应用技术与安全控制重点实验室保存。
YPD培养基、YPD液体培养基、WL培养基:均为商业培养基,购于青岛高科技工业园海博生物技术有限公司,按使用说明加蒸馏水溶解后灭菌。
液体筛选培养基(g/L):EC作为唯一氮源,EC 2.5,葡萄糖2.0,KH2PO4 2.0,乙酸钠2.0,NaCl 2.0,溴甲酚紫0.001,若配置固体培养基则加入琼脂20.0;pH 5.0。
复筛培养基(g/L):蛋白胨1.0,葡萄糖2.0,NaCl 2.0,KH2PO4 2.5,EC 2.5,溴甲酚紫0.001;pH 5.0。
葡萄汁培养基:葡萄汁与蒸馏水按1∶1的体积比配制。
1.2 主要试剂和仪器设备
氨基甲酸乙酯(EC)、氨基甲酸丙酯(nPC),北京索莱宝科技有限公司;葡萄糖、K2HPO4、KH2PO4、无水乙酸钠、NaCl、蛋白胨、琼脂、溴甲酚紫(以上试剂均为分析纯),天津大茂化学试剂厂;二氯甲烷、正己烷、甲醇(以上试剂均为色谱纯),阿拉丁(上海)试剂有限公司;酵母基因组DNA提取试剂盒,天根生化科技(北京)有限公司。
SW-CJ-2FD型洁净工作台,苏州安泰空气技术有限公司;YXQ-LS-50SII型立式压力蒸汽灭菌器、BSD-150型生化培养箱,上海博讯医疗生物仪器股份有限公司;8860-5977B型GC-MS联用仪,美国安捷伦公司;NBS-I型氮吹仪,合肥艾本森科学仪器有限公司;PEN3型电子鼻,德国Airsense公司。
1.3 实验方法
1.3.1 菌株筛选
1.3.1.1 初筛
将多个品种的酿酒葡萄鲜果、干化葡萄破碎后,常温下自然发酵24 h;称取酒醅10 g,加入90 mL无菌生理盐水,振荡培养12 h,得到菌悬液。将菌悬液接种于液体筛选培养基中[10],28 ℃培养24 h,对其进行梯度稀释,在WL培养基上进行涂布,后经过划线分离纯化得到纯种的单菌落,对形态符合酵母菌形态的菌株进行保存。再对每株菌进行验证,将菌株再次接入液体筛选培养基,观察是否发生变色反应,若变色则证明其可以降解EC,在对其进行复筛。
1.3.1.2 复筛
将初筛得到的具有EC降解能力的菌株,接种至复筛培养基中,28 ℃恒温静置培养10 d后,对复筛培养基中EC的含量进行测定,从中选取EC降解能力较强的菌株进行发酵性能比较。
1.3.1.3 发酵性能实验
(1)菌株的发酵能力试验。采用杜氏小管法,将菌株接种于内置杜氏小管的试管中,28 ℃培养36 h,观察杜氏小管气泡体积,比较各菌株发酵能力的强弱。
(2)菌株的耐受性试验。将各菌株接种于体积分数分别为3%、6%、9%、12%、15%的无水乙醇和SO2含量分别为60、180、300 mg/L的YPD液体培养基中,28 ℃培养36 h,比较各菌株的耐受性。结合发酵性能和耐受性试验结果,从中选取较优菌株进行发酵实验。
(3)发酵实验。取经过筛选的菌株进行发酵实验,将赤霞珠葡萄除梗破碎后,装入500 mL 三角瓶中,装液量为70%,加入50 mg/L SO2和 20 mg/L果胶酶,65 ℃水浴20 min,用水迅速冷却至室温后接种酵母菌(细胞浓度为107 CFU/mL),发酵温度控制在28 ℃,发酵12 d 后,添加90 mg/L SO2,装满罐于4 ℃贮存,澄清数天后对各处理葡萄酒的理化指标、EC、挥发性成分进行测定,同时进行电子鼻分析,以商业酵母XR作为对照。
1.3.2 菌株鉴定
18S rDNA分子鉴定:将上述菌株接入YPD液体培养基中静止培养12 h,离心弃上清液,收集菌体。使用酵母基因组DNA提取试剂盒提取酵母基因组,扩增后送上海生工生物工程股份有限公司测序,测序结果采用 NCBI Blast中进行同源序列比对,使用 MEGA X软件中的邻近法(Neighbor-Joining) 进行系统发育树的构建,并用Bootstrap对进化树进行1 000次置信度分析。
1.4 测定方法
1.4.1 EC的测定
复筛培养基样品中EC的测定:样品处理与标准工作溶液配制参照文献[12]的方法,GC-MS分析条件参照国标GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》,略有修改。葡萄酒中EC的测定:参照国标GB 5009.223—2014《食品安全国家标准 食品中氨基甲酸乙酯的测定》,略有修改。
1.4.2 葡萄酒理化指标的测定
总酸、酒精度和挥发酸含量参照国标 GB/T 15038—2006《葡萄酒、果酒通用分析方法》测定,pH值使用pH计测定,总糖含量的测定使用苯酚硫酸法[13]。
色度、色调参照文献[14]的方法测定。
1.4.3 葡萄酒挥发性风味物质的测定
样品的前处理与GC-MS分析条件参照文献[15]的方法,定性、定量参照文献[16]的方法,略有修改。
1.4.4 电子鼻分析
参照文献[17]的方法测定。
2 结果与分析
2.1 降解EC酵母菌的筛选
2.1.1 初筛结果
本研究利用EC水解酶能够降解EC反应产生氨与乙醇,从而使菌株可以在以EC为唯一氮源的培养基中存活,同时使溴甲酚紫由黄变紫的原理,筛选得到了18株酵母菌作为初筛目的菌株,菌株编号见表1。
表1 菌株初筛结果
Table 1 Preliminary screening results of strains

2.1.2 复筛结果
通过对初筛菌株接入的复筛培养基中EC浓度进行比较(图1),有7株对EC有较高降解能力的酵母菌,对EC的降解量达到181.97~261.5 mg/L,分别为NXU5、NXU7、NXU8、NXU11-2、NXU12-2、NXU14、NXU17-1,对这7株菌进行后续实验。

图1 复筛培养基中EC含量
Fig.1 EC content in secondary screening medium 注:小写字母不同表示差异显著(P<0.05)(下同)
2.1.3 发酵性能比较
2.1.3.1 发酵能力比较
对复筛结果中的7株菌种的产气结果进行比较(表2),7株菌中有4株菌产气充满杜氏小管,分别为:NXU5、NXU7、NXU11-2、NXU12-2,说明这4株酵母菌起酵能力强。
表2 筛选菌株的杜氏小管产气情况
Table 2 Screening strains of gas production in Dulbecco’s tubules

注:“+”:产气量为杜氏小管体积的1/4;“++”:产气量为杜氏小管体积的1/2;“+++”:产气量为杜氏小管体积的3/4,“++++”:产气量为杜氏小管满体积
2.1.3.2 耐受性比较
将通过发酵能力筛选的4株菌进行乙醇耐受性试验,结果如图2-a所示。在乙醇体积分数为3%~15%时,随着酒精浓度的升高,菌浓度整体呈现下降的趋势;酒精体积分数为15%时,菌株NXU11-2、NXU12-2菌浓度要明显高于其他菌株。如图2-b所示,在SO2质量浓度为60~300 mg/L时,随着SO2浓度的升高,菌浓度整体呈现下降的趋势;在SO2质量浓度到达300 mg/L时,所有菌株仍可以生长。结合耐乙醇实验结果,最终选择菌株NXU11-2、NXU12-2进行后续发酵实验。
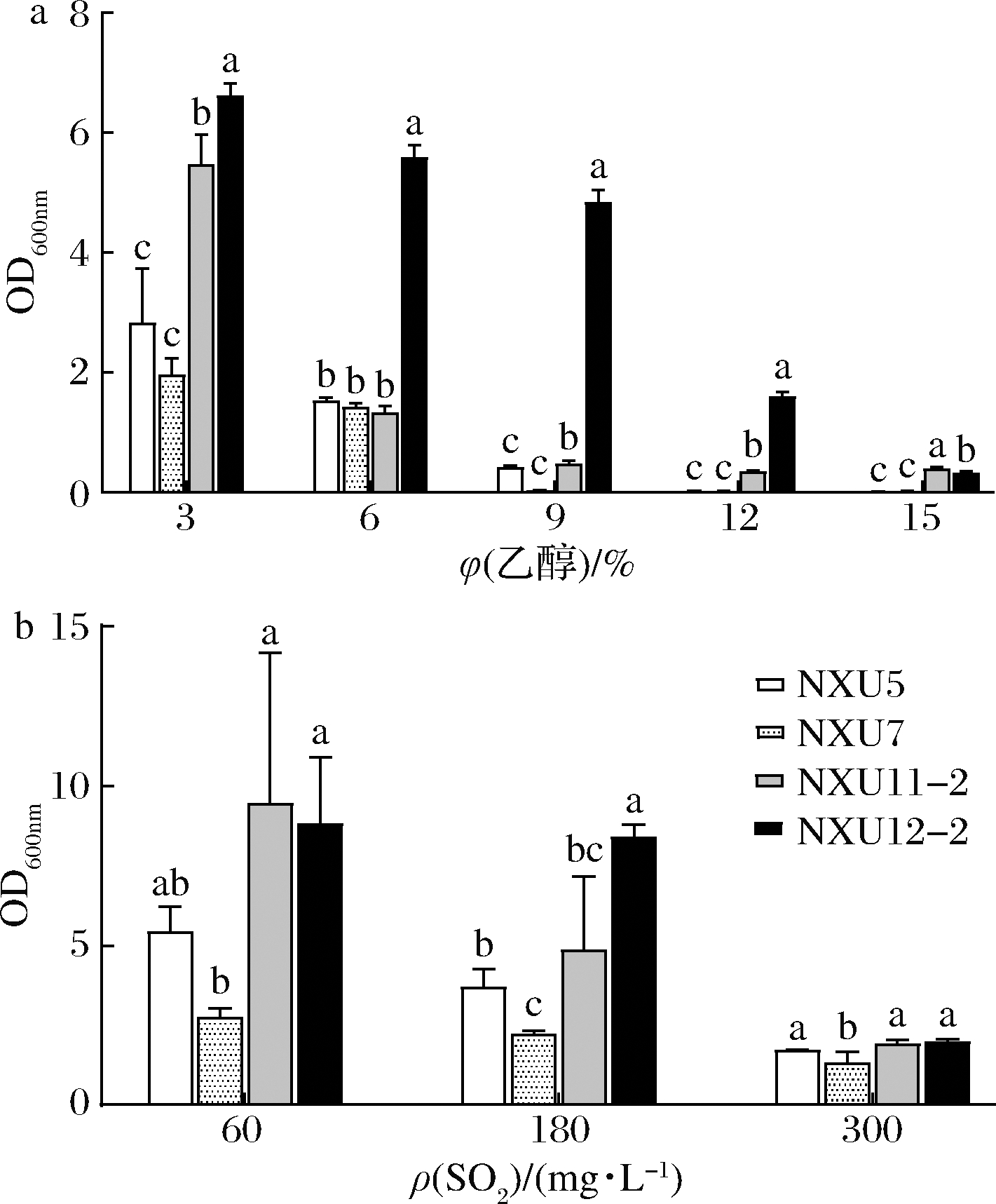
a-耐乙醇实验; b-耐SO2实验
图2 乙醇耐受性和SO2耐受性实验
Fig.2 Tolerance to alcohol and SO2
2.1.3.3 发酵实验
(1)理化指标与EC含量。对复筛所得到的NXU11-2与NXU12-2菌株进行发酵实验,结果如表3所示,通过葡萄酒中EC含量的测定得出,菌株NXU12-2的含量最低为18.96 μg/L,仅为商业酵母XR含量的53.13%。葡萄酒的挥发酸均在国标范围之内;总糖方面XR的含量最低,NXU12-2含量相对较高;总酸方面,NXU12-2含量最高;酒精度NXU12-2处于最低水平。近年来随着全球气候变暖,成熟酿酒葡萄含糖量升高,导致葡萄酒中乙醇含量升高[18],酒精度较低有利于生产低酒精度的葡萄酒,以迎合当前的消费者[19]。色泽是评价红葡萄酒品质的重要依据[20],不同菌株发酵葡萄酒的色度和色调值如图3所示,NXU12-2与XR的色度值相差最小,NXU12-2与XR的色调值无显著差异。
表3 葡萄酒理化指标
Table 3 Physicochemical indexes of wine samples

注:同一列字母不同表示差异显著(P<0.05)
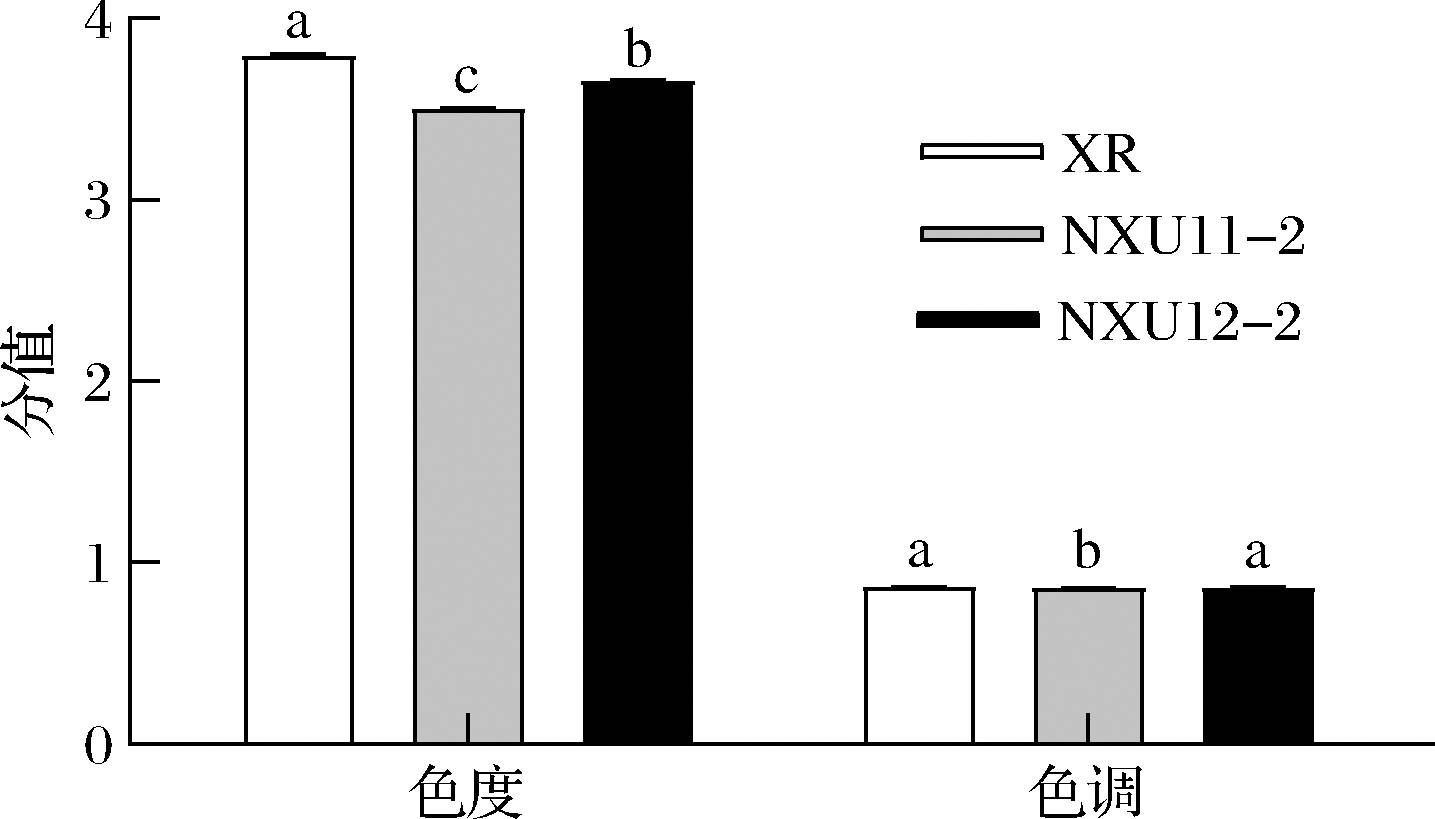
图3 葡萄酒色度与色调分析
Fig.3 The chromaticity and tonal analysis of wine samples
(2)葡萄酒香气成分分析。葡萄酒的香气很大程度上决定了葡萄酒的质量。通过顶空固相微萃取结合气相色谱-质谱联用法测定了葡萄酒中香气成分含量,结果见增强出版附件。实验共检测到44种香气物质,包括12种酯类、12种醇类、5种脂肪酸类、2种萜烯类、1种降异戊二烯衍生物、4种醛类、1种硫醇、1种内酯、2种酮类、2种烷烃类以及2种其他类。
酯类物质是葡萄酒香气的重要组成部分,各菌株发酵酒中酯类物质的含量为2 212.47~3 615.05 μg/L,NXU12-2酒样低于XR与NXU11-2。其中,共有3种酯类物质的OAV>1,分别为乙酸异戊酯、己酸乙酯和辛酸乙酯。酒样NXU12-2与XR相比,己酸乙酯和辛酸乙酯含量较低,乙酸异戊酯含量无显著区别。酒样NXU11-2与XR相比,3种物质含量均无显著区别。
高级醇是酵母代谢产生的次级产物,当葡萄酒中的高级醇含量低于300 mg/L 时,对葡萄酒香气具有积极贡献,可增加葡萄酒香气的复杂性[21]。酸类物质能够提高葡萄酒香气的复杂性,是葡萄酒中重要的一类香气物质[22]。各菌株发酵酒中,高级醇和脂肪酸的含量NXU12-2均为最高,总含量分别为18 548.20~35 446.90和187.22~345.13 μg/L。酒样中的醇类物质异戊醇、苯乙醇、异丁醇和1-壬醇含量较高;酸类物质异丁酸、辛酸等含量较高,酒样NXU12-2与XR相比,异戊醇含量无显著区别,1-壬醇含量较低,增加了苯乙醇(OAV>1)、异丁醇和异丁酸、辛酸、9-癸烯酸,增加了葡萄酒中的花香味、甜味和奶酪味,减少了生青味。
除此之外,芳樟醇、大马士酮、壬醛、异佛尔酮和2,4-二叔丁基苯酚的OAV也超过了1。芳樟醇为酒体带来花香,XR的含量最高;大马士酮为酒体带来花香、甜味、蜂蜜味, NXU12-2含量最高,对酒体香气的复杂性有一定的贡献。
(3)葡萄酒香气成分的主成分分析。为了直观地展示各实验组之间的差异,对于OAV>0.1的21种香气物质进行主成分分析。由图4可知,前2个主成分的总贡献率为79.2%,其中主成分1的方差贡献率46.9%,主成分2的方差贡献率为32.3%。其中,NXU12-2位于第一象限,与大马士酮、苯乙醇、辛酸、甲硫醇的相关性较强,赋予酒体复杂浓郁的花香、甜味和奶酪味;对照组XR位于第二象限,与芳樟醇、异佛尔酮、1-壬醇、丁酸乙酯、9-癸烯酸联系紧密,为酒体带来花香、脂肪味和生青味;NXU11-2位于第三象限,与乙醛和乙酸乙酯有较大关联,为酒体带来果香、醇味和甜味等。通过主成分分析,发现NXU11-2、NXU12-2和XR的香气特征都较好,可用于高质量葡萄酒的酿造。
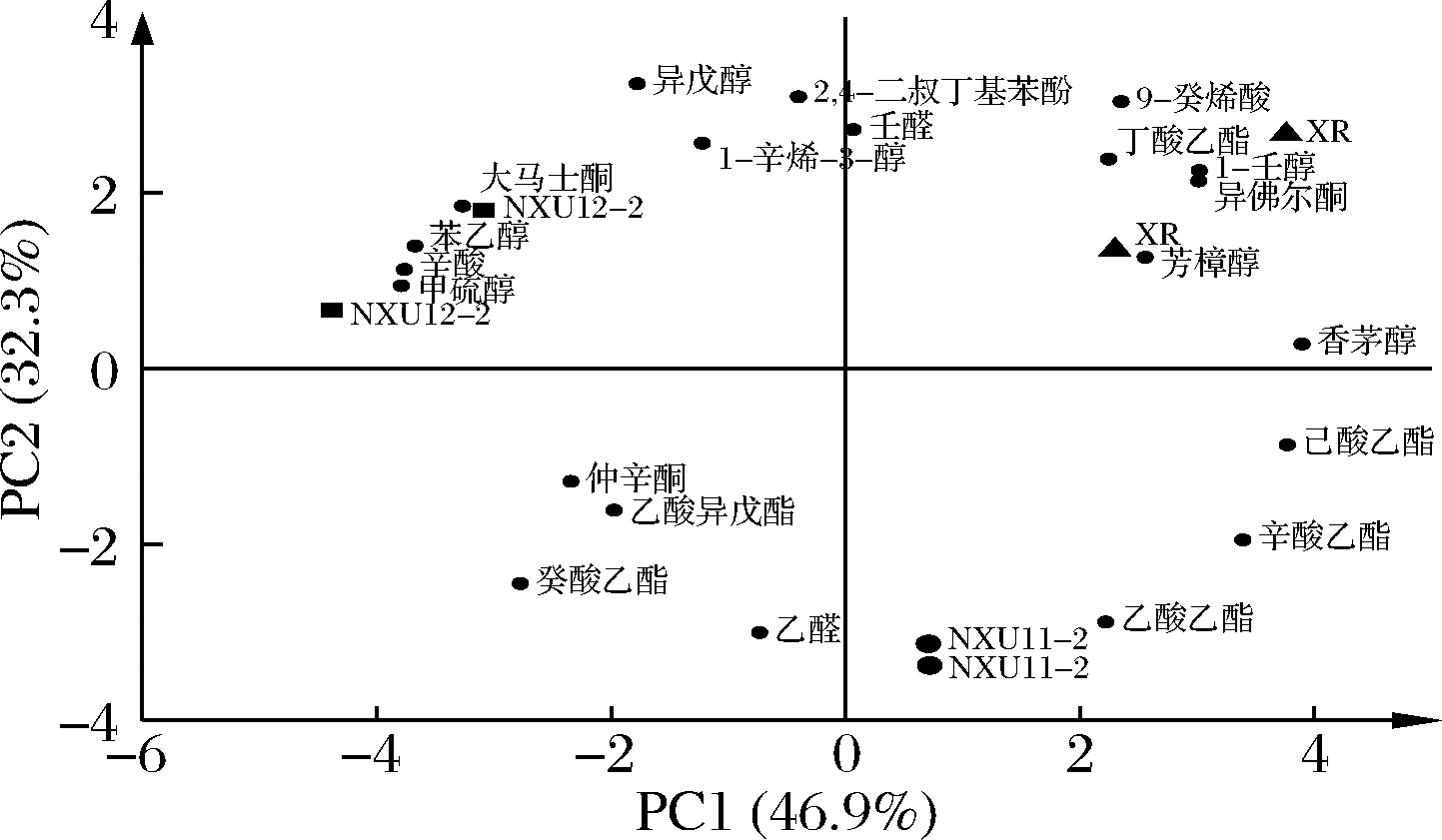
图4 葡萄酒香气物质(OAV>0.1)的主成分分析图
Fig.4 Principal component analysis plot of aroma substances in wine (OAV>0.1)
(4)电子鼻雷达图分析。图5为葡萄酒电子鼻雷达图分析结果,从中可以看出 W1C、W5S、W1S、W1W、W2S、W2 W 六个传感器对酒样的响应较高,其余4个传感器响应较低。XR在 W5S、W1S两个传感器响应最高,说明其中氮氧化合物、甲烷等短链烷烃类芳香化合物含量较高;NXU12-2在W2S传感器响应最高,说明其中醇醚醛酮类芳香化合物含量较高,各酒样间差异不明显。
综合初筛、复筛和发酵能力的比较,最终选择菌株NXU12-2作为发酵性能良好的目的菌株。
2.2 降解EC酵母菌的鉴定
将该菌株18S rDNA序列与NCBI数据库中进行BLAST比对,结果表明,此菌株18S rDNA序列与酿酒酵母18S rDNA的相似度为99%。根据菌株的18S rDNA序列,利用 Mega 5.0 软件建立系统发育进化树,采用 Neighbor-Joining 法对菌株进行分析。由图6可知,它与酿酒酵母在一个系统发育支上,因此可确定该菌株为酿酒酵母,并命名为NXU12-2。
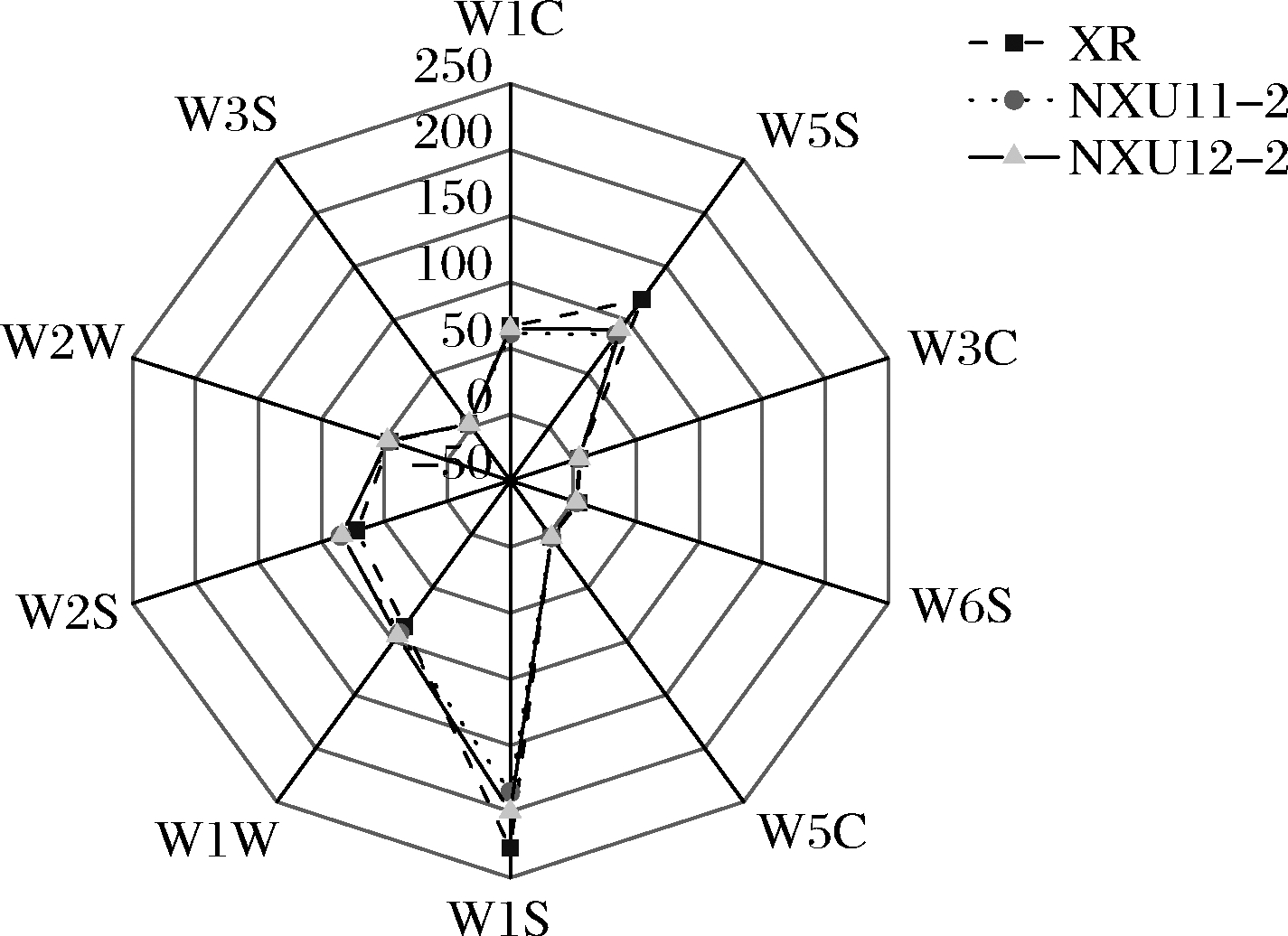
图5 葡萄酒电子鼻雷达图
Fig.5 Electronic nose radar chart of wine
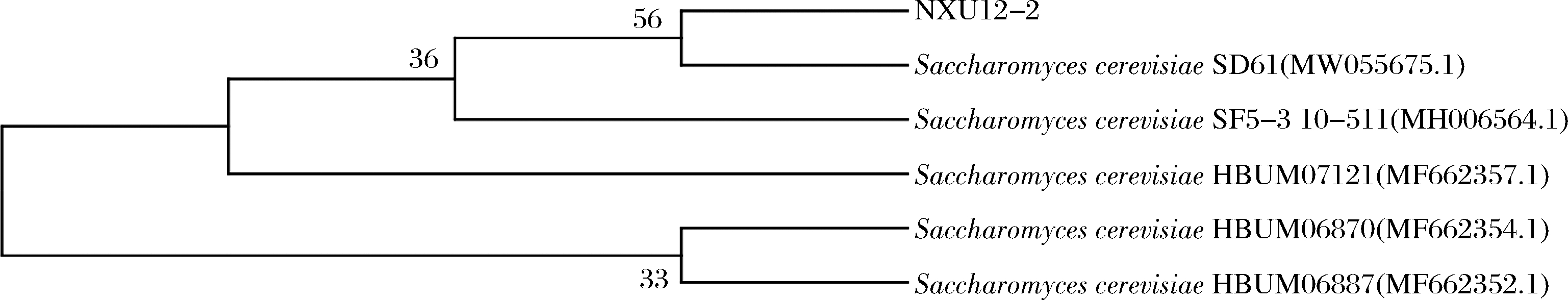
图6 NXU12-2 18 s rDNA基因系统发育分析
Fig.6 Phylogenetic tree of 18S rDNA gene of NXU12-2
3 结论
本研究从酿酒葡萄、干化葡萄和白酒酒醅中筛选得到可降解氨基甲酸乙酯的酵母菌18株,选择7株降解能力较强的菌株进行发酵性能实验和耐受性实验,得到2株酵母菌NXU11-2与NXU12-2。对这2株菌进行发酵实验,结果表明,使用NXU12-2酿造的葡萄酒EC含量最低,葡萄酒的酒精度、总酸等指标较优,香气特征较好,经鉴定为酿酒酵母。研究表明,使用酿酒酵母NXU12-2酿造的葡萄酒品质较优,同时降低了酒中EC的含量,对葡萄酒中EC的控制具有重要意义。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



