黑曲霉脂肪酶基因的克隆及其在黑曲霉中的同源表达
脂肪酶(EC 3.1.1.3,lipase)又称为三酰基甘油水解酶,是一类重要的水解酶,可催化酯水解、酯化和酯交换等反应[1-3]。脂肪酶普遍存在于自然界中,在植物、动物和微生物中均有发现[4]。目前脂肪酶的工业化生产主要利用微生物发酵[5-6]。脂肪酶在两相界面、水性介质或有机相体系中均能进行催化反应,是工业生产应用的关键酶,在生物柴油、食品、化妆品、皮革、纺织、洗涤业和制药等领域具有良好的应用前景[7-8]。
黑曲霉作为外源蛋白表达宿主,具有优异的蛋白分泌能力、准确的翻译后加工能力以及出色的遗传稳定性,同时具有良好的安全性。黑曲霉表达系统在表达重组蛋白领域具有巨大潜力,逐渐成为蛋白工厂[9-10]。黑曲霉脂肪酶多为胞外酶,因此不仅可以利用液体培养基进行发酵,还能采用低成本的固体培养基进行生产。朱思远[11]通过转录和转录后水平改造提高了黑曲霉脂肪酶的表达量,开展了CRISPR/Cas9技术在黑曲霉表达系统中的应用,构建了尿嘧啶缺陷型菌株。但是近年来对于微生物资源的开发利用率相对较低,仅在1%左右[12]。脂肪酶在工业化生产中也面临着生产效率不高的问题,因此探索提高脂肪酶产量和活力的方法是当前研究的热点[13-14]。
本研究利用生物学信息库进行信息分析和对比,对黑曲霉基因组中的脂肪酶功能基因进行挖掘和筛选。利用原生质体-PEG转化法构建黑曲霉工程菌,实现8种黑曲霉来源脂肪酶基因的同源表达。通过对表达质粒启动子和信号肽的优化以提高蛋白表达水平,并对重组脂肪酶进行纯化和酶学性质表征。
1 材料与方法
1.1 菌种与质粒
黑曲霉(Aspergillus niger)AS3.350、E.coli DH5α、E.coli Rosetta(DE3)、黑曲霉MA、质粒pCAMBIA和质粒pET-28a(+)均为本实验室保存。
1.2 材料与试剂
DNA聚合酶、限制性内切酶、DNA凝胶回收试剂盒,宝日医(北京)生物技术有限公司;质粒小提试剂盒、片段纯化试剂盒和RNA提取试剂盒,北京全式金生物有限公司;一步克隆连接试剂盒,南京诺唯赞生物科技有限公司。
1.3 黑曲霉脂肪酶基因的生物信息分析
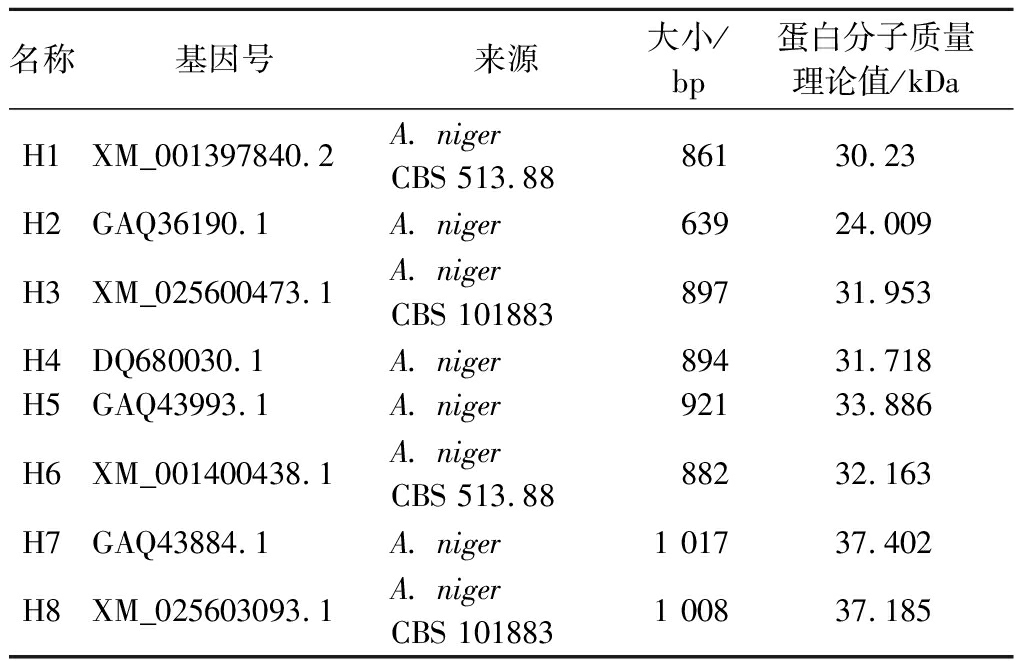
从NCBI数据库中查找黑曲霉来源脂肪酶并比对分析后,选取了8个黑曲霉脂肪酶,目的基因详情见表1。利用在线工具MAFFT对这8个脂肪酶的编码序列进行多序列比对,利用在线工具SignalP4.1对这8个脂肪酶进行信号肽预测等生物信息学分析。
表1 脂肪酶基因来源和氨基酸信息
Table 1 The sources of lipase gene and amino acid information
1.4 黑曲霉脂肪酶基因克隆与表达
黑曲霉AS3.350总RNA的提取、cDNA的制备与纯化按照试剂盒说明书进行,质粒和PCR产物酶切、连接、热激法转化、原生质体-PEG转化法及转化子筛选等均采用实验室常规方法进行[15]。
1.5 黑曲霉工程菌转化质粒的优化
1.5.1 含不同信号肽质粒的构建
分别设计引物pCAMBIA-F和pCAMBIA-ScbhΙ-R;pCAMBIA-F和pCAMBIA-SANL-R以pCAMBIA-PgpdA-SglaA-H3为模板扩增。将含有不同信号肽的目的基因与载体连接构建pCAMBIA-PglaA-ScbhΙ-H3和pCAMBIA-PglaA-SANL-H3重组质粒。将不同质粒转入黑曲霉宿主,通过对酶活力的测定和SDS-PAGE分析,选择最优的黑曲霉系统表达信号肽。
1.5.2 含不同启动子质粒的构建
设计引物pCAMBIA-PglaA-F和pCAMBIA-PglaA-R以pCAMBIA-PgpdA-SglaA-H3为模板扩增。将PglaA启动子与载体连接构建pCAMBIA-PglaA-SglaA-H3重组质粒并转入黑曲霉宿主,通过酶活力的测定和SDS-PAGE分析,选择最优的黑曲霉系统表达启动子。
1.6 黑曲霉工程菌的活化与发酵培养
将4 ℃保藏的菌种划线到潮霉素B抗性质量浓度为200 μg/mL的PDA平板上,30 ℃培养4 d,用无菌水冲洗孢子做成孢子悬液,充分振荡30 min。按0.8%的接种量接入到75 mL液体发酵培养基中,30 ℃、150 r/min摇床培养6 d。发酵培养基(g/L):玉米淀粉50,玉米浆30,豆粕粉20。
1.7 黑曲霉脂肪酶的分离与纯化
收集发酵培养后的发酵液,用300目的过滤筛滤去菌丝体,将粗酶液于10 000 r/min离心10 min,保留上清液,再用0.22 μm的微滤膜进行微滤。将粗酶液用镍柱亲和层析树脂纯化,收集纯化的酶液,透析去除高浓度咪唑获得纯化后的酶溶液。
1.8 脂肪酶的酶活力测定方法
利用对硝基苯酚乙酸酯(pNPA)作为底物进行脂肪酶酶活力的检测。脂肪酶能够水解pNPA产生对硝基苯酚(p-NP)。在pH 7.0,40 ℃条件下,1 min释放1 μmol的p-NP为1个酶活力单位。
1.9 黑曲霉脂肪酶的酶学性质表征
1.9.1 酶最适温度及温度稳定性
在不同温度(25~60 ℃)下,通过测定脂肪酶ANL-H3催化pNPA的水解活性来确定酶的最适反应温度。将最适温度条件下的酶活力定义为100%。将酶溶液分别放置于不同温度(25~60 ℃)下孵育2 h,每隔20 min取样检测酶液的水解活性,观察ANL-H3的热稳定性。将放置0 h酶液的酶活力定义为100%。
1.9.2 酶最适反应pH及pH稳定性
在不同pH值(pH 5.0~9.0)下,使用pNPA作为底物测定脂肪酶ANL-H3的水解活性来确定酶的最适pH。在4 ℃条件下,将酶液分别置于(pH 5.0~9.0)的缓冲溶液中2 h,每隔20 min取样测定酶液的水解活性,观察ANL-H3的pH稳定性。将放置0 h的酶液的酶活力定义为100%。各pH缓冲体系分别为:50 mmol/L柠檬酸-柠檬酸钠缓冲溶液(pH 5.0~5.5);50 mmol/L磷酸盐缓冲溶液(pH 6.0~8.0);50 mmol/L Tris-HCl缓冲溶液(pH 8.5~9.0)。
1.9.3 酶的催化底物特异性
以不同碳链长度脂肪酸(C2~C16)的对硝基苯酚酯为底物,在40 ℃,pH 7.0的条件下测水解活性。将最高酶活力定义为100%。
1.9.4 金属离子对酶活性的影响
在酶溶液中分别加入终浓度为1和5 mmol/L的金属离子(Na+、Mn2+、Ca2+、K+、Mg2+、Cu2+、Fe3+、Ni2+和Zn2+),在4 ℃放置1.5 h,随后测定脂肪酶ANL-H3催化pNPA的酶活力,以未添加金属离子处理的酶液作为对照组。计算相对酶活力,将对照组的酶活力定义为100%。
1.9.5 有机溶剂对酶活性的影响
在标准反应体系中分别加入5%、10%的有机溶剂(甲醇、乙腈、丙酮、DMF、DMSO和四氢呋喃),在4 ℃放置1.5 h,测定脂肪酶ANL-H3催化pNPA的酶活力,以不加有机溶剂的酶液作为对照组。计算相对酶活力,将对照组的酶活力定义为100%。
1.10 黑曲霉脂肪酶的动力学参数测定
在最佳测定条件下,计算黑曲霉脂肪酶ANL-H3在不同pNPA浓度下(1~100 mmol/L)的反应初速度。利用软件Origin 8.5非线性拟合(参考Michaelis-Menten方程)得到米氏常数Km和最大反应速率Vmax。
2 结果与讨论
2.1 黑曲霉脂肪酶基因的克隆及工程菌的构建
利用生物学信息库信息分析和全基因组检索发现结构和功能与已知酶类似的同源酶编码序列和一些未探究的编码片段,对黑曲霉全基因组中脂肪酶功能基因进行挖掘筛选,选取了8个来源于黑曲霉,分子质量为20~40 kDa的黑曲霉脂肪酶基因。以黑曲霉AS3.350的cDNA为模板,对该8个基因进行PCR扩增,并命名为H1~H8。重组质粒pCAMBIA-H1(-8)转化在黑曲霉MA中,获得H1(-8)重组黑曲霉工程菌,命名为MA-H1(-8)。
2.2 高活力黑曲霉脂肪酶工程菌的筛选
检测8个黑曲霉工程菌MA-H1(-8)发酵10 d的上清液的脂肪酶活力,结果如图1所示。转化子MA-H2和MA-H3的酶活力较高,最高酶活力分别为1.37和1.41 U/mL。分别取重组脂肪酶转化子酶活力最高的发酵上清液进行SDS-PAGE分析,MA-H2、MA-H3的酶活力最高,相应泳道中目的蛋白条带也较粗,说明了这2个重组黑曲霉菌株有较高的蛋白表达量,考虑到最高酶活力以及发酵周期长短等因素,最终选择黑曲霉脂肪酶ANL-H3基因作为目标脂肪酶基因进行后续的优化研究。
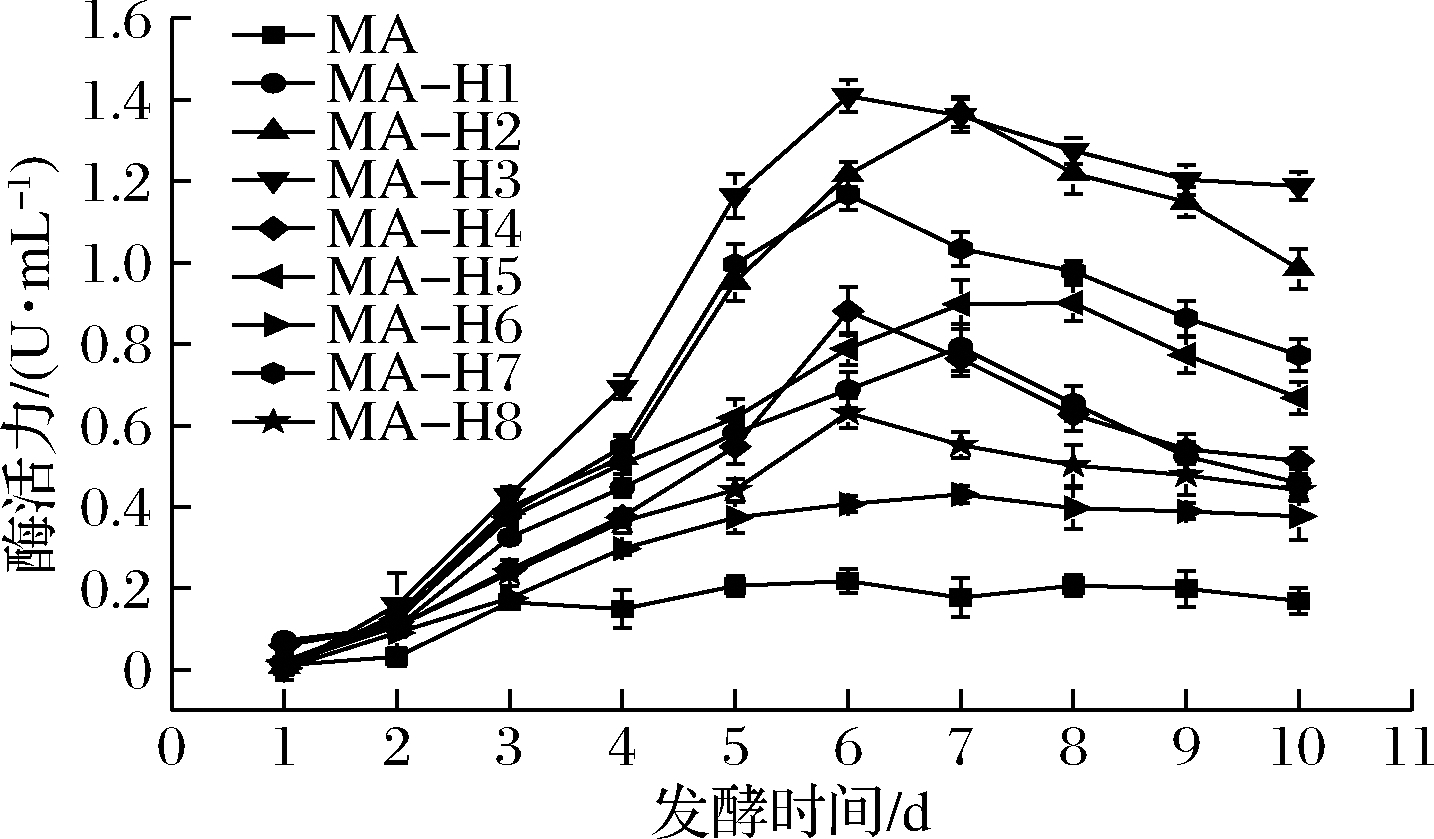
图1 黑曲霉工程菌发酵上清液的酶活力情况
Fig.1 Enzyme activity in fermentation supernatant of A. niger engineering strain
2.3 黑曲霉脂肪酶基因信号肽和启动子的优化
信号肽对蛋白质的外源表达具有非常关键的影响,信号肽连接目的蛋白形成1个蛋白嵌合体,最终的分泌效率受到其构型、表面电荷分布和分子质量等因素的影响[16]。扩增带有cbhΙ信号肽和ANL信号肽的目的基因,构建pCAMBIA-PglaA-ScbhΙ-H3和pCAMBIA-PglaA-SANL-H3重组质粒,将质粒片段转入黑曲霉宿主。经酶活力测定,以glaA、cbhΙ和ANL为信号肽的脂肪酶活力分别为1.41、1.12和0.57 U/mL。因此选择glaA为最优的黑曲霉系统表达信号肽。
以黑曲霉cDNA为模板扩增PglaA启动子,构建pCAMBIA-PglaA-SglaA-H3重组质粒。将质粒片段转入黑曲霉宿主,以PglaA为启动子的重组工程菌的蛋白表达量更高,而且其脂肪酶酶活力为1.68 U/mL,比以PgpdA为启动子的重组菌的酶活力高,因此选择PglaA为最优的黑曲霉系统表达启动子。通过插入基因的修饰以提高黑曲霉脂肪酶表达量的优化实验,最终选择pCAMBIA-PglaA-SglaA-H3重组质粒进行后续实验研究。
2.4 黑曲霉脂肪酶的分离与纯化
利用镍离子亲和层析柱纯化酶蛋白,洗脱下来的蛋白溶液经超滤管(10 kDa)超滤除盐和浓缩,纯化后脂肪酶的比活力达31.44 U/mg,纯化倍数为65.5倍,但酶活力的回收率较低,仅为7.84%。
2.5 黑曲霉脂肪酶的酶学性质
2.5.1 酶最适温度和温度稳定性
在不同的温度下,ANL-H3的酶活力变化结果如图2所示。在25~45 ℃,ANL-H3活性随着温度升高逐渐增加,ANL-H3的最适温度是45 ℃。当温度进一步升高,酶活力显著下降。
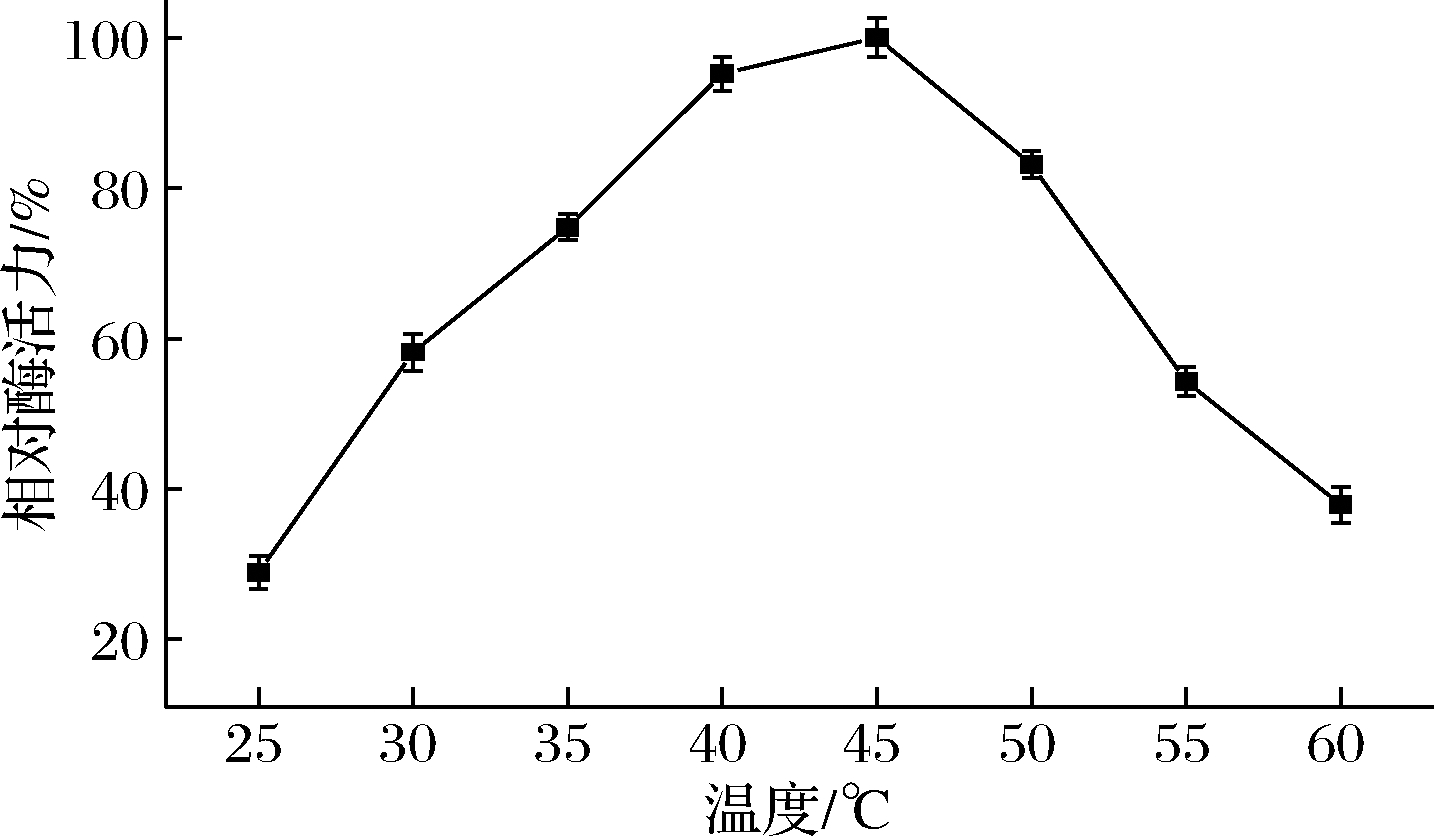
图2 温度对黑曲霉脂肪酶ANL-H3活性的影响
Fig.2 Effects of temperature on the activity of ANL-H3
进一步测定了ANL-H3在不同温度条件下保持2 h酶残留的活力,以考察其热稳定性,结果如图3所示。在25~40 ℃下,ANL-H3酶活力基本保持不变;在45~55 ℃下的仍可以保持80%以上的酶活力,当酶蛋白在60 ℃处理2 h,酶活力开始下降,维持在初始活力的60%左右,说明ANL-H3拥有良好的热稳定性。在实际应用中,结合最适温度与温度稳定性这2个因素,选择45 ℃为最适反应温度。
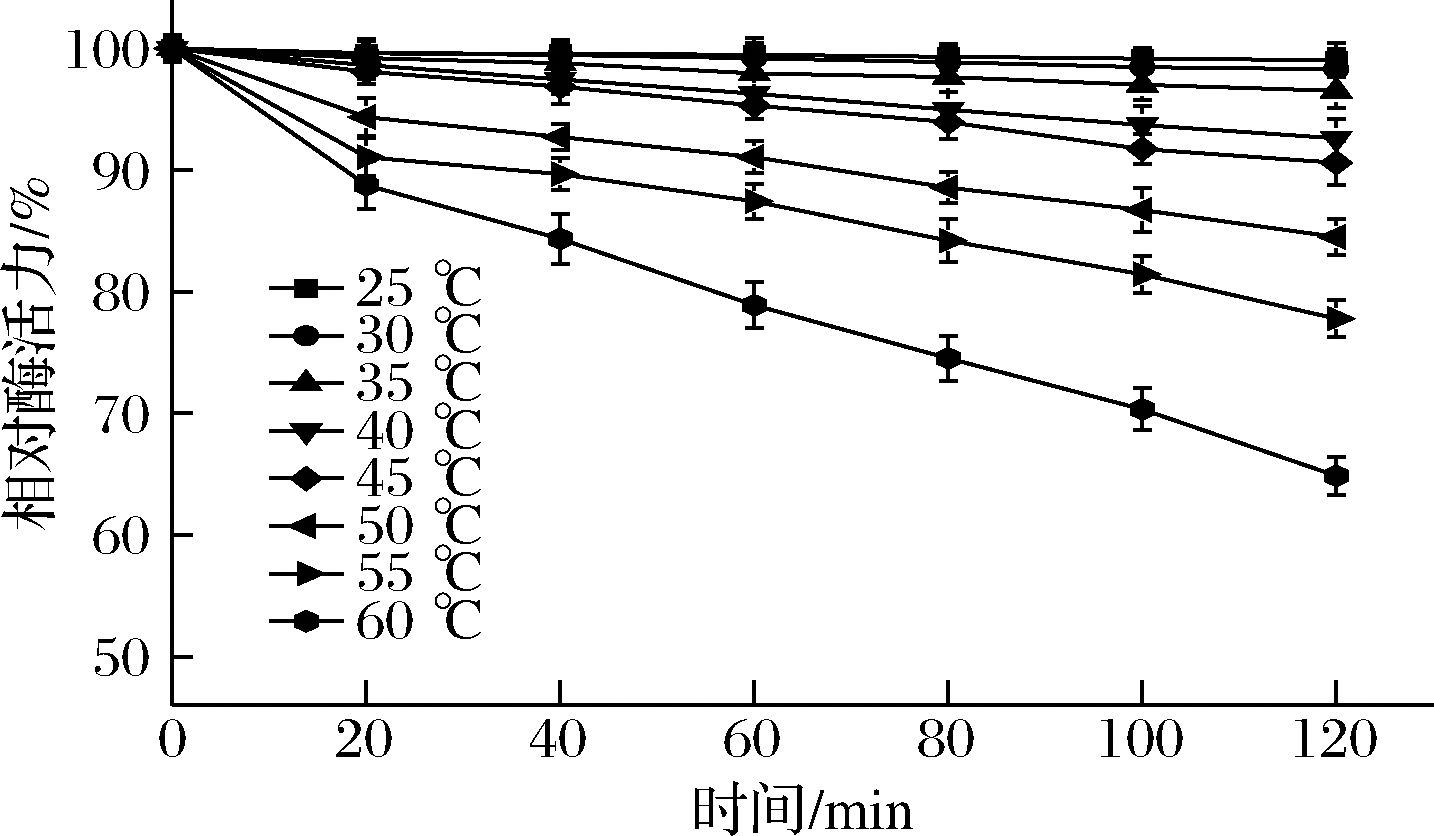
图3 黑曲霉脂肪酶ANL-H3的温度稳定性
Fig.3 The thermal stability of ANL-H3
2.5.2 酶最适pH和pH稳定性
考察不同pH条件下脂肪酶ANL-H3的水解活性,结果如图4所示,ANL-H3的最适pH为7.5,在pH 7.0~8.0都具有较高的活性,酶活力保持在85%以上。随着pH的进一步下降或升高,酶活力均明显下降,表明ANL-H3的最适pH范围为中性条件。
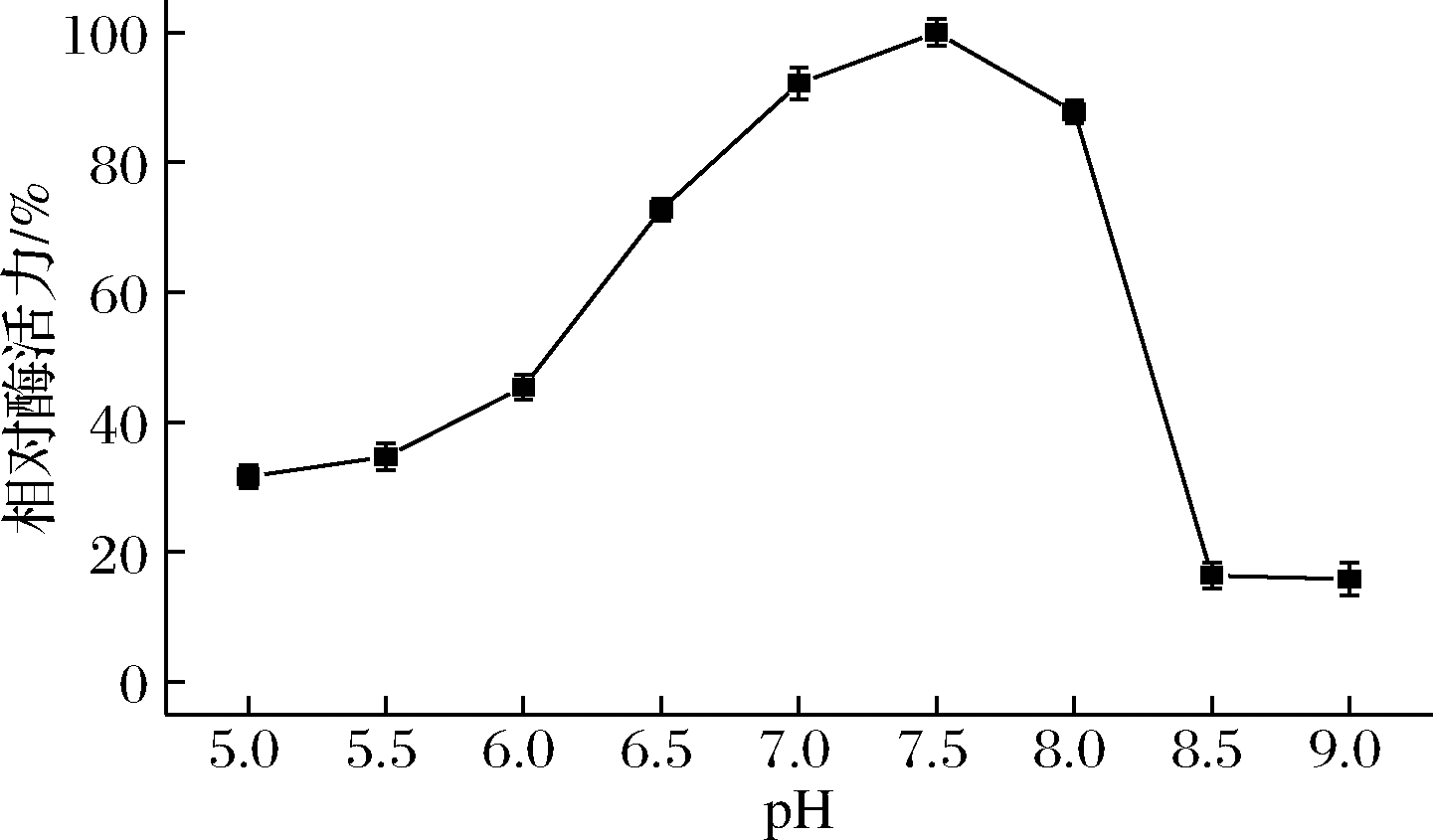
图4 pH对黑曲霉脂肪酶ANL-H3活性的影响
Fig.4 Effects of pH on the activity of ANL-H3
将该酶在4 ℃,不同pH条件下处理2 h,结果如图5所示,ANL-H3在最适pH下最为稳定,酶活力保持在95%以上;在pH 6.0~8.0,ANL-H3的酶活力均保持在75%以上,具有良好的稳定性。在pH酸性或者强碱性条件下处理2 h,酶残留活力下降至55%左右,结果表明该酶是一种pH中性酶。
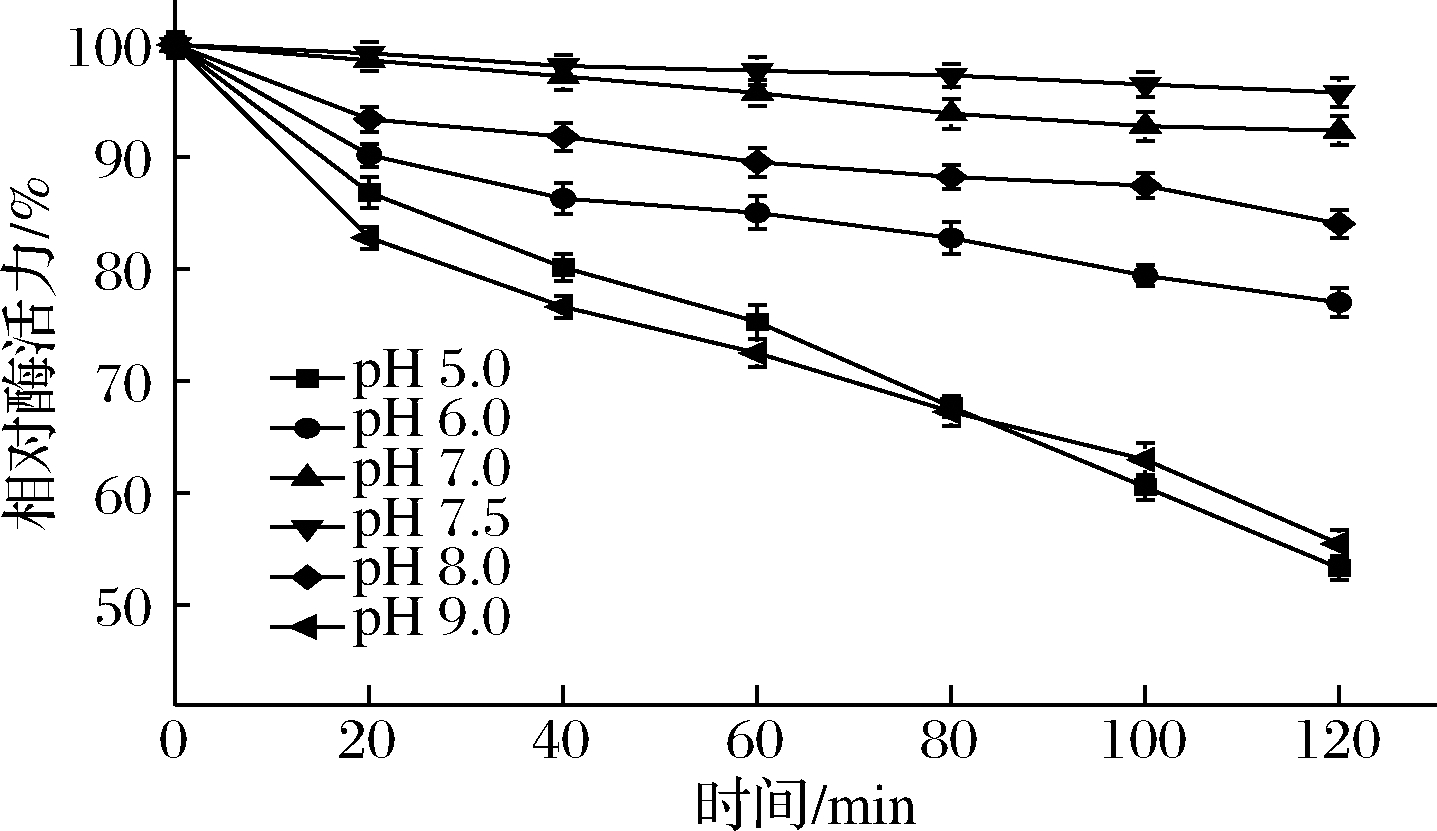
图5 黑曲霉脂肪酶ANL-H3的pH稳定性
Fig.5 The pH stability of ANL-H3
2.5.3 酶的催化底物特异性
分别以不同碳链长度脂肪酸(C2~C16)的对硝基苯酚酯为催化底物,探究脂肪酶ANL-H3的底物特异性。由图6可知,ANL-H3对不同碳链长度底物的水解活性不同,其中对pNPA的催化活性最高,具有较广的底物特异性,对不同碳链长度脂肪酸酯的底物都有良好的催化活性。
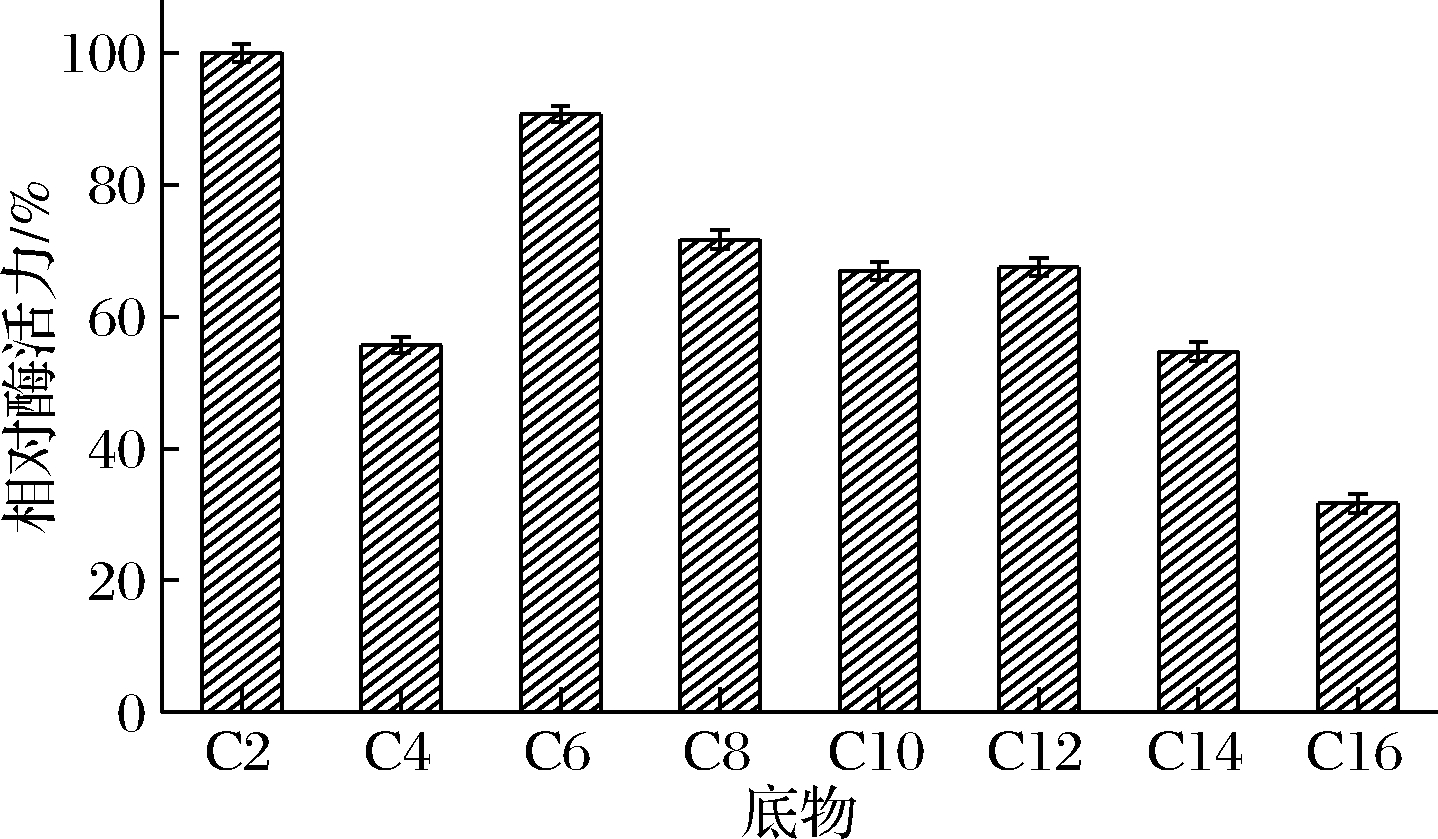
图6 黑曲霉脂肪酶ANL-H3对p-NP酯的底物特异性
Fig.6 Substrate specificity of ANL-H3 towards pNP esters
2.5.4 金属离子对酶活力的影响
金属离子是影响酶催化性能的重要参数之一[17]。金属离子可以通过与酶的二硫键作用,从而改变酶的结构。考察不同金属离子对ANL-H3的影响,实验结果如图7所示。结果表明在离子浓度较低(1 mmol/L)时,金属离子对脂肪酶的抑制作用不明显,其中Mg2+、K+等有激活作用;当离子浓度为5 mmol/L时,Mn2+、Cu2+完全抑制脂肪酶的活性,酶活力只有对照组的10%左右。Mg2+、K+等金属离子对ANL-H3有较明显的激活作用,可分别提高20%~30%左右的酶活力。
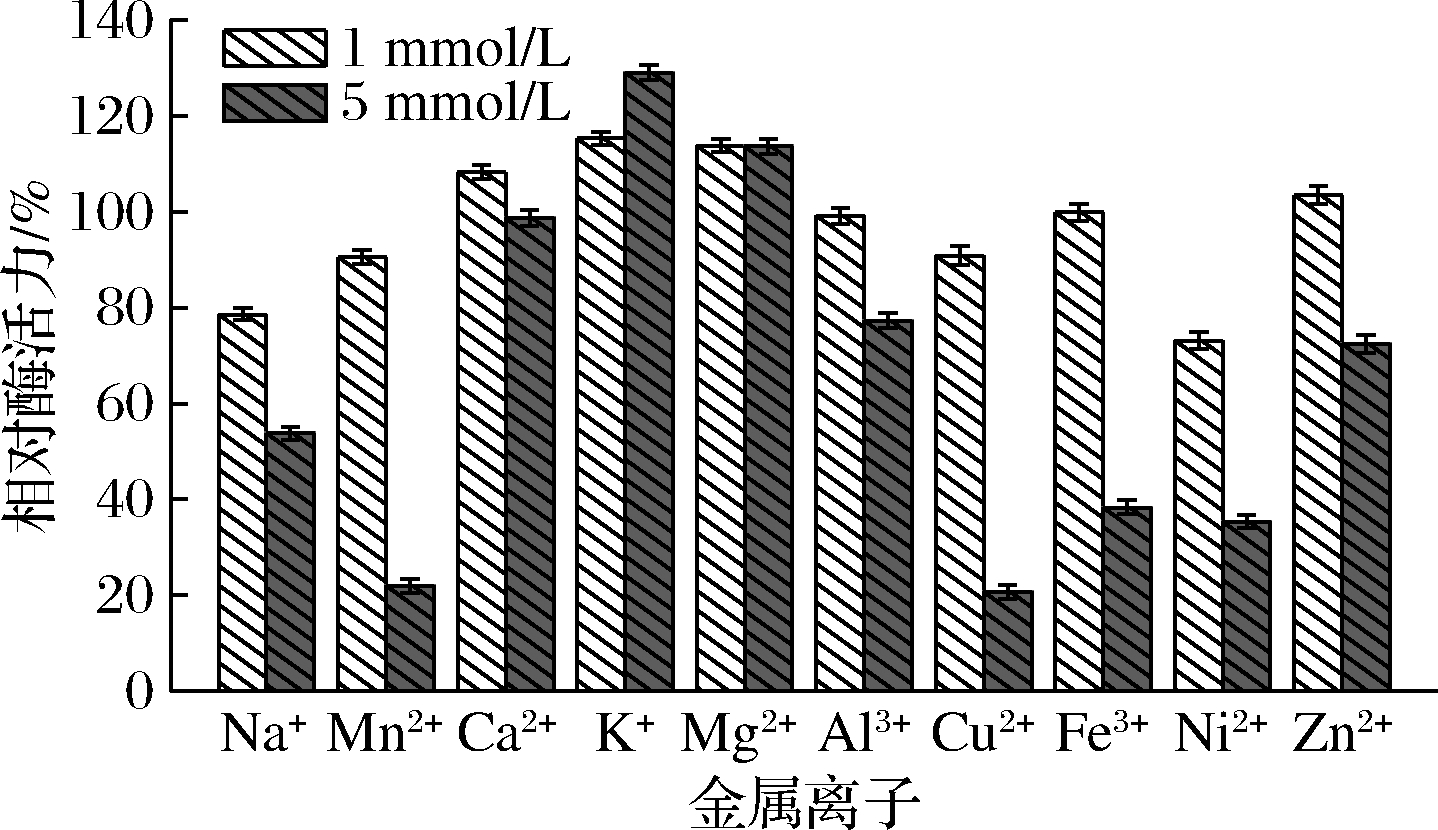
图7 金属离子对黑曲霉脂肪酶ANL-H3活性的影响
Fig.7 Effects of metal ions on the activity of ANL-H3
2.5.5 有机溶剂对酶活力的影响
酶催化反应可在非水相介质中进行,由于有机溶剂等非水相介质对催化体系pH值、离子浓度及极性等性质的改变,使得酶蛋白分子在非水相介质中容易失去催化活性[18-19]。在酶催化反应体系中分别加入5%和10%的有机溶剂,以不加有机溶剂作为对照组。由图8可知,甲醇和DMSO对ANL-H3酶活力有一定的促进作用,在甲醇和DMSO质量分数为10%时,酶活力分别为对照组126.5%和116.23%,其余4种溶剂对ANL-H3有不同程度的抑制作用。
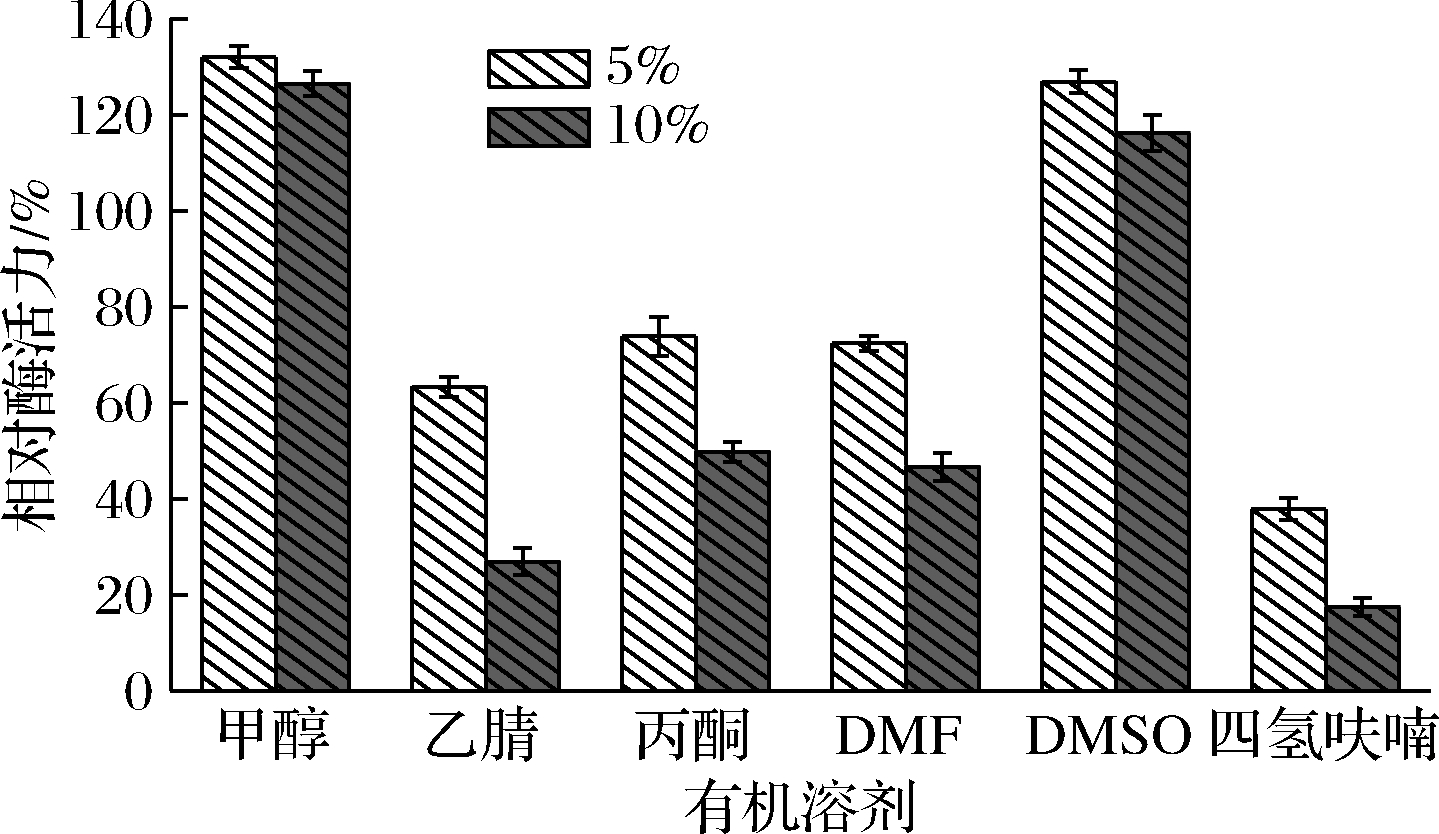
图8 有机溶剂对黑曲霉脂肪酶ANL-H3活性的影响
Fig.8 Effects of organic solvents on the activity of ANL-H3
2.6 黑曲霉脂肪酶的动力学参数
以pNPA为底物,在0.1~3.0 mmol/L浓度下测定脂肪酶ANL-H3的动力学参数,所得结果如图9所示。根据实验数据计算,通过Origin 8.5拟合获得的米氏常数Km为1.893 mmol/L,最大反应速度Vmax为1.610 mmol/(L·min),催化常数kcat为90.45 min-1,催化效率kcat/Km为47.78 L/(min·mmol),kcat/Km被认为能最全面的衡量酶催化能力的指标,数值越大催化效率越高。ANL-H3的Km值低表明其对底物pNPA的亲和力高,酶促反应易于进行[20],且ANL-H3的Kcat/Km值较高,表明酶的催化效率较高。

图9 黑曲霉脂肪酶ANL-H3以pNPA为底物的米氏方程图
Fig.9 Michaelis-Menten equation diagram of ANL-H3 using pNPA as substrate
3 结论
本研究以1株低蛋白背景的黑曲霉MA作为表达宿主,构建以潮霉素B抗性为筛选标记的重组表达质粒,实现8种不同黑曲霉脂肪酶基因在黑曲霉中的同源表达,确定表达最好的转化子MA-H3-PglaA-SglaA。经重组表达与分离纯化后,该重组酶的比酶活力为31.44 U/mg,纯化倍数为65.5倍,酶纯化的回收率为7.84%。在以pNPA为底物时,酶的最适温度为45 ℃,最适pH为7.5。ANL-H3对pNPA(C2)的水解活力最高,倾向于中短链脂肪酸的底物。在高浓度的金属离子条件下,Mn2+、Cu2+使ANL-H3基本失活,K+、Mg2+等金属离子对ANL-H3有较明显的激活作用。ANL-H3对甲醇和DMSO有较好的有机溶剂耐受性。ANL-H3的米氏常数Km为1.893 mmol/L,Vmax为1.610 mmol/(L·min),kcat为90.45 min-1,催化效率kcat/Km为47.78 L/(min·mmol)。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



