低酯果胶胶凝特性研究进展及应用
果胶是一种结构复杂的酸性杂多糖,广泛存在于自然界各种高等陆生植物的初生细胞壁中[1],可通过各种提取方法获得,包括酸法提取、酶法提取、辅助法提取等[2-3]。果胶常作为胶凝剂、增稠剂、乳化剂等应用于食品工业[3-5],如果酱、果冻、蜜饯、酸奶等食品的生产[6]。此外,果胶还具有显著的保健作用,如降血糖、降胆固醇、抗癌、调节胃肠功能、吸附有害金属离子等[7]。因而,国际食品添加剂联合委员会认为果胶是安全的食品添加剂,对其每日允许摄入量不作限定。
食品工业中,果胶最主要的用途之一是用作胶凝剂。根据酯化程度不同,果胶可分为高酯果胶(high methoxyl pectin, HMP)和低酯果胶(low methoxyl pectin, LMP),HMP是指果胶分子结构中有超过50%的半乳糖醛酸单元被甲酯化,即酯化度大于50%,而LMP酯化程度小于50%。HMP胶凝时需要低的pH值(2.0~3.8)和较高浓度的可溶性固形物(如55%~75%的蔗糖)。当pH值较低时,HMP分子中游离的羧酸基团解离程度被极大抑制,减小了分子间静电斥力,同时较高含量的可溶性固形物优先和水分子结合,降低了果胶分子的溶剂化程度,使得果胶分子彼此靠近,最终形成三维凝胶网络。基于这一特性,当前HMP常作为饮料增稠剂、高糖果酱胶凝剂和酸奶稳定剂应用于食品加工。但由于HMP胶凝时需添加大量的可溶性固形物,导致产品糖分含量较高,不符合现代低热量食品的开发趋势,一定程度上限制了HMP的应用。然而,LMP胶凝时仅需Ca2+参与,对可溶性固形物含量没有特殊要求[8],胶凝时pH值范围较广。这是因为LMP羧基基团较多,形成凝胶时主要依赖于解离的羧基基团与二价阳离子(如Ca2+)之间的静电引力,而氢键与疏水相互作用仅起到稳定三维网络结构的作用。LMP的胶凝特性特别适用于生产低糖果酱、果冻、酸奶或其他无糖保健食品,这也是低酯果胶在现代食品工业中应用的主要趋势。因此,本文基于LMP的结构特征,综述了果胶分子结构特点与其胶凝机理的关联,探讨了各因素对LMP凝胶特性的影响。此外,也总结了近年来LMP在食品研发中的应用进展,旨在为拓宽LMP在食品与保健领域中的应用提供理论依据。
1 LMP的分子结构与胶凝机理
1.1 LMP分子的基本结构
尽管当前对果胶分子的结构组成还存有一些争论,但主流观点都倾向于认同O′NEILL等[9]的研究,认为果胶分子可分为同型聚半乳糖醛酸区(homogalacturonan, HG)、鼠李半乳糖醛酸聚糖I型区(rhamnogalacturonan-Ⅰ, RG-I)以及鼠李半乳糖醛酸聚糖II型区(rhamnogalacturonan-Ⅱ, RG-II)3部分。HG是由数百个连续的D-半乳糖醛酸残基经α-(1→4)糖苷键连接而成的线性区域,构成了超过65%的果胶结构,是果胶结构的主链,因此HG区也被称为平滑区[10]。HG区域中,部分半乳糖醛酸残基C6位上的羧基以甲酯化状态存在,未被甲酯化的羧基则以解离酸的形式,或以钾盐、钠盐、铵盐、钙盐等形式存在[11]。HG区域中平均每100个半乳糖醛酸残基在C6位上以甲酯化形式存在的比例即定义为果胶分子的酯化度(degree of esterification,DE)或甲基化程度(degree of methoxylation,DM)。除DE值外,目前还以DB值(degree of blockiness)评估LMP中未被甲酯化的半乳糖醛酸单元的分布情况。DB值定义为内聚半乳糖醛酸酶降解果胶后释放的单个半乳糖醛酸、二聚半乳糖醛酸和三聚半乳糖醛酸的量占果胶中非甲酯化的半乳糖醛酸总量的比例(图1)。此外,HG的半乳糖醛酸残基可能发生酰胺化,被氨基取代。RG-I区域主要由α-D-半乳糖醛酸与α-L-鼠李糖通过糖苷键连接而成的二糖重复单元组成,其中20%~80%的鼠李糖在C3或C4位上的羟基氧上连接着由阿拉伯糖、半乳糖组成的长短不一的支链。RG-I的半乳糖醛酸残基在C2和C3位还可能被乙酰基取代。RG-II通常被描述为HG的延伸结构,仍然以α-(l→4)-D-半乳糖醛酸链为主要组成部分,但不同于主链的是该区域支链化程度较高,支链上含有4种已知的寡糖,包括洋芹糖、海藻糖、木糖、半乳糖醛酸。此外,RG-Ⅱ区域还可能包含其他成分,如乙酸、槭汁酸、葡萄糖醛酸等,受植物种类、生长环境、成熟程度以及果胶提取部位的影响而有所差异[3]。由于RG-I和RG-II区域都含有较多的支链结构,因此统称为毛发区(图1)。

图1 LMP基本结构特点[3]
Fig.1 The fundamental structure characteristics of low methoxyl pectin
1.2 LMP制备方式对分子结构的影响
目前,LMP不仅可从天然植物组织中提取获得,也可将HMP脱酯化处理获得。有研究报道,LMP广泛存在于天然植物组织中,如向日葵盘、豆腐柴叶、薜荔籽、甜瓜、马铃薯渣、菠萝蜜皮、可可豆荚壳、甘薯、假酸浆籽粒等[12-14]。然而,目前仅有向日葵盘中提取的LMP实现了商业化,市面上常见的苹果和柑橘LMP主要是通过将它们的HMP进行脱酯化处理后获得[11]。
1.2.1 提取方式对LMP结构的影响
对于包含LMP的天然植物组织,提取方式对LMP结构特点有明显影响。天然的果胶物质以原果胶、果胶、果胶酸的形态存在植物组织中,果胶提取的原理是将水不溶性的原果胶转化为水溶性果胶并将其分离出植物组织的过程。主要的果胶提取方法包括酸法提取,超声辅助提取,微波辅助提取,微生物法提取,酶法提取等。酸法提取是利用高温酸性溶液水解原果胶,使其转化为水溶性果胶溶出,再通过乙醇或金属离子将果胶沉淀分离。该方法容易导致果胶解聚,使得果胶分子质量降低。刘新新等[15]研究发现,与硝酸、盐酸等无机强酸相比,采用柠檬酸、草酸等有机弱酸提取果胶效果较好,可有效避免果胶结构遭到破坏。超声波和微波提取分别靠空化效应和辐射加热破坏植物组织促使果胶分离,通常作为辅助方法与传统果胶提取方法结合使用,能有效提高果胶的提取效率、降低能量消耗。例如,EZZATI等[16]利用超声与微波辅助法提取了向日葵盘果胶,发现得到的LMP半乳糖醛酸含量高、分子质量较大,并且表现出良好的胶凝性、乳化性、热稳定性和抗氧化性。微生物法提取和酶法提取分别利用微生物发酵和酶的催化作用将细胞壁降解从而使果胶从植物组织中分离。这2种方法制得的果胶分子质量较高,提取率优于酸法提取,但是生产成本高、周期长、条件难以控制,目前尚未实现规模化应用。
1.2.2 去酯化方式对LMP结构的影响
目前,市售的LMP主要是通过将高酯苹果果胶或柑橘果胶进行去酯化处理得到,常见方式包括碱法脱酯,酸法脱酯,酶法脱酯,酰胺化法脱酯。碱法和酸法脱酯均是以水解的方式随机脱去甲氧基,因此导致获得的LMP的DB值较低。再者,碱或酸处理虽然能有效地脱除果胶分子的甲氧基,但仍会引起果胶分子的降解,包括HG主链降解或侧链降解等,进而降低果胶分子质量和改变果胶的分支化程度。而酶法脱酯的原理与碱法和酸法脱酯不同,其原理是通过外加或激活植物中原本存在的果胶甲酯酶,促使甲基化的半乳糖醛酸脱酯,降低果胶DE值。与化学方法相比,果胶甲酯酶以序列脱除的方式脱去果胶分子的甲氧基,脱脂后LMP中游离的半乳糖醛酸残基呈区域化分布,DB值较高、胶凝能力也更好。WAN等[17]采用高静压辅助酶法脱酯制备了LMP,发现获得的LMP的平均分子质量大于碱法脱酯获得的果胶,不仅脱酯效率高,而且凝胶性能也更好。为了降低酶法脱酯的成本,TALEKAR等[18]采用了交联酶聚集法对柑橘果胶甲酯酶进行处理,提升了果胶脱酯的催化效率,同时降低了酶反应的pH和温度要求。对HMP进行酰胺化改性以降低果胶的DE也是生产LMP的重要方法。在此过程中,被酯化的半乳糖醛酸残基的甲基基团被氨基取代,称为果胶的酰胺化程度(degree of amidation, DA)。苏东林等[19]用酰胺化法制备了低酯柑橘果胶,发现与普通LMP相比,酰胺化的LMP形成凝胶时所需的Ca2+数目更少,且凝胶硬度更大,具有较好的热可逆性。
1.3 LMP的胶凝机理
LMP的胶凝是指在Ca2+存在的条件下,果胶分子中半乳糖醛酸残基解离的羧基基团与Ca2+结合形成离子键,进而形成三维网络结构的过程。其中,一个Ca2+可以结合2个位于不同果胶链上的羧基基团,这种结合被形象地描述为“蛋盒”模型。具体解释为,2条果胶链反向平行,不同果胶分子链上的非甲酯化的半乳糖醛酸单元互补、形成规则的几何形空穴,Ca2+镶嵌在内,以离子键的方式与半乳糖醛酸单元结合,且至少需要6~20个连续排列的“蛋盒”单元才能形成稳定的分子间交联[20]。当前普遍认为,LMP胶凝时与Ca2+的结合分为两步(图2-a)。首先,Ca2+与相邻2个果胶分子发生交联,形成二聚体,这种二聚体结构主要通过氢键作用稳定;其次,多个二聚体之间发生氢键作用,聚合形成四聚体、六聚体等,不断形成连续的立体分布,进而促进三维凝胶网络的形成[20]。一般而言,LMP和Ca2+结合形成凝胶时,果胶分子和Ca2+越容易形成交联、构成的交联区越多,则胶凝速率越快、凝胶强度越高。需要指出的是,尽管与Ca2+的结合是LMP胶凝化的主要原因,但由于果胶结构复杂,部分果胶虽然结构上划分为LMP,但这些果胶仍然可以在Ca2+不存在的条件下形成微弱的凝胶结构[21]。其中,氢键和疏水相互作用是维系这类凝胶网络的主要作用力。
2 LMP凝胶的性质及其影响因素
食品质构不仅是消费者十分重视的感官特征,也是食品质量评价的一项重要指标[22]。就LMP而言,其凝胶的性质不仅决定了LMP作为食品胶凝剂的品质,也决定了其在改善食品质构、开发新型食品类型的应用前景。
2.1 自身结构特点对LMP胶凝化的影响
LMP自身的结构特点是影响其胶凝特性的重要因素,即便对于同一种果胶,分子结构不同也会引起其胶凝性质的较大差异。一般而言,DE值、DB值、分子质量、分支化程度均能影响LMP的胶凝过程。
2.1.1 DE值与DB值
虽然DE值低于50%的果胶都可归类于LMP,但就LMP而言,DE越低,果胶结构中游离的羧基基团就越多,越容易和Ca2+结合,因此胶凝速率越快。此外,由于LMP分子上带有的甲氧基有阻碍未被甲酯化的半乳糖醛酸残基进入到凝胶结合区的作用[23],因此DE也影响LMP胶凝时Ca2+的用量。DE较高的LMP胶凝时往往需要较多的Ca2+。
另一方面,近年来有报道指出,果胶DE一定时,未被甲酯化的半乳糖醛酸单元分布不同,果胶的胶凝特性也不同。通常,果胶结构中未被甲酯化的半乳糖醛酸以随机分布模式或“block”分布模式存在。随机分布模式是指未被甲酯化的半乳糖醛酸单元以随机的方式分布于HG主链中;“block”分布模式则是指未被甲酯化的半乳糖醛酸单元以连续排列的方式分布。如上所述,当连续排列的6~20个非甲酯化半乳糖醛酸单元和Ca2+结合时,相邻的果胶分子才能形成稳定的交联区,从这一层面而言,“block”分布模式显然更有利于LMP与Ca2+结合形成稳定的分子间交联[3]。一般LMP的DB值越高,表明未被甲酯化的半乳糖醛酸单元以“block”模式分布的可能性就越高,因而也越容易和Ca2+结合。LÖFGREN等[24]从柠檬中提取了DM值基本相同但DB值不同(16%,5%)的2种果胶,并对其胶凝动力学进行了分析,发现DB值低的果胶储能模量更低、胶凝速率更缓慢,而DB值高的果胶则更易形成凝胶。CELUS等[25]则是以柑橘果胶作为初始原料,采用果胶甲酯酶处理得到DB值为20.0%~82.4%的一系列果胶,通过等温滴定量热法测定了果胶分子与Ca2+结合所需的能量,结果发现随DB值升高,果胶分子与Ca2+结合所需的能量能越少,意味着果胶分子越易与Ca2+结合。
2.1.2 分支化程度
分支化程度也对LMP的胶凝能力有一定影响。根据LMP的基本结构特点,中性糖主要构成了“毛发区”,即RG-I型和RG-II型区域,而半乳糖醛酸主要构成了HG主链,导致半乳糖醛酸与中性糖、半乳糖醛酸之和的摩尔比可近似用来描述果胶的分支化程度。比值越高,表明果胶分支化程度越低[26]。由于LMP胶凝主要是由于HG主链中未被甲酯化的半乳糖醛酸单元的羧基基团和Ca2+的结合,因而当其他分子结构参数相同时,分支化程度越高,果胶和Ca2+结合的空间位阻作用越大,导致果胶越不容易和Ca2+结合形成交联。此外,当果胶分子质量相同时,分支化程度越高,果胶分子的流体力学体积越低,溶液黏度也降低,不利于果胶分子二聚体彼此结合,也降低了LMP的胶凝能力[25]。然而,对于某些结构特殊的LMP而言,氢键是诱导凝胶形成的主要作用力,这种情况下,果胶分支化程度越高,反而利于果胶分子彼此接触形成氢键缔合,进而形成凝胶。CHEN等[27]从柑橘囊衣中提取了RG-I型区域含量不同的果胶,其中RG-I型区域含量为63%的果胶与RG-I型区域比例为41%的果胶相比,形成的凝胶网络结构不规则且更为稀疏,流变学性能更差。值得一提的是,由于RG-I型区域主要包含中性糖,因此具有良好的氢键形成能力,和传统果胶复合可起到协同胶凝作用。
2.1.3 分子质量与分子浓度
LMP分子结构相同时,分子质量越大,果胶在水溶液中所占的流体力学体积越大,越容易形成黏稠的溶液,因此有利于果胶分子彼此靠近形成交联越有利于形成凝胶。一般情况下,分子质量高(≥300 kDa)的果胶,增稠效果较好,最低胶凝浓度也更低[28]。而低较分子质量(≤10 kDa)的果胶,可能会由于其Ca2+结合位点的数量有限而无法形成凝胶[29]。
浓度也是影响LMP凝胶性质的重要因素。当LMP浓度较低时,倾向于形成Ca2+介导的分子内交联,对凝胶强度的提高贡献不大。随浓度增加,体系中果胶分子数目增多,有利于凝胶网络形成,且由于较多的果胶分子能结合更多的水,因此果胶浓度越高,凝胶强度和持水性也越高[30-31]。但当果胶浓度过高时,制得的凝胶强度虽高,但弹性降低、易破碎、整体外观较差。在实际应用中,LMP的添加量一般为0.5%~2.0%,对于分子质量较低的LMP,可以适度增加使用量[32]。
2.2 外部环境因素对LMP胶凝化的影响
除果胶自身的结构特点外,外部环境因素如Ca2+浓度、pH值、温度、溶质含量等也对LMP的胶凝有明显影响。
2.2.1 金属离子浓度
2.2.1.1 Ca2+浓度
对于特定的果胶溶液,其胶凝行为很大程度上取决于体系中游离的Ca2+数目和果胶分子中解离的羧基数目之比,通常以R值描述。R值定义为Ca2+浓度的2倍与游离的羧基基团浓度之比(R=2[Ca2+]/[COO—])。当果胶分子中解离的羧基基团数目一定时,理论上总存在一个最佳的Ca2+浓度,可以和解离的羧基基团形成最大数目的离子交联,称为饱和R值[26]。当Ca2+浓度低于饱和R值时,升高Ca2+浓度会促使果胶二聚体形成,从而增加果胶的胶凝速率和凝胶强度(图2-b)。当Ca2+浓度高于饱和R值时,增加Ca2+浓度并不能明显增加果胶的凝胶强度。当Ca2+浓度过高时,凝胶强度反而降低,原因是果胶分子在高的Ca2+浓度环境中优先与Ca2+结合形成单聚体,减少了果胶分子间的交联。例如,VENTURA等[33]采用X射线小角散射法系统研究了不同Ca2+浓度下,LMP和Ca2+形成的交联情况。结果发现,低Ca2+浓度时(R<1),果胶分子形成“杆状交联”、“点状交联”及“单聚体”3种纳米结构,且3种结构共存。高Ca2+浓度下(R>>1),“杆状交联”数目降低,“点状交联”及“单聚体”数目增多,果胶分子交联密度降低(图2-c)。值得注意的是,尽管随R值增加,LMP的凝胶强度均会出现先升高后降低的趋势,但实际情况中,果胶的最大凝胶强度并非总在R=1时出现。一般而言,LMP达到最佳凝胶强度时,R值总是倾向于高于理论饱和R值(即R=1),主要是因为并非体系中所有的游离的Ca2+都可以和解离的羧基基团结合。例如,YULIARTI等[31]对麻疯树叶子中提取的果胶进行了凝胶性质研究,发现R=3时凝胶强度最高。
Ca2+添加量是调控LMP凝胶特性的重要因素。通常,随Ca2+添加量增加,LMP凝胶强度、弹性、持水能力均会呈现增加的趋势,因为Ca2+浓度增加时,果胶形成了更多的分子间交联,网络更密集,不仅增加了凝胶强度,同时也提供了更为显著的毛细管作用力,能够束缚更多的水分子。然而,当Ca2+添加量过高时,凝胶强度降低、凝胶质地更为粗糙、且更容易析水,这是由于过高的Ca2+浓度反而降低量果胶分子间的交联程度。因此,LMP胶凝过程中存在一个最佳的Ca2+添加量,高于或低于最佳的Ca2+添加量均会导致凝胶质地变差。果胶结构和外部环境因素均会引起最佳Ca2+添加量的变化,与LMP的半乳糖醛酸含量、DE、DA以及溶液的pH值有关。由于最佳Ca2+添加量总是略大于理论饱和R值(R=1),因此实际应用时,可近似根据R=1估计合适的Ca2+添加量。
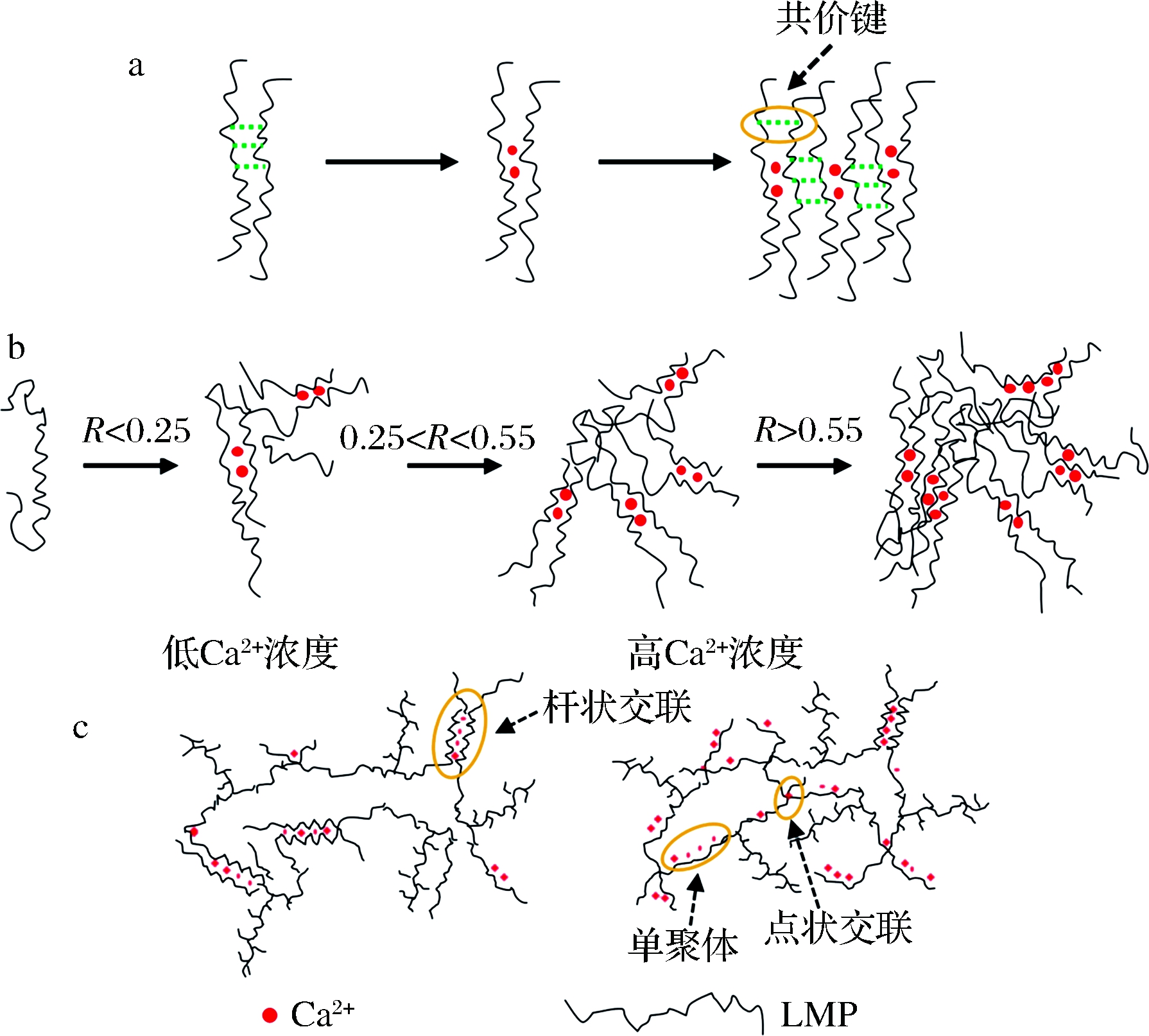
a-LMP和Ca2+的结合分为两步;b-不同Ca2+浓度下LMP和
Ca2+的结合;c-LMP-钙凝胶网络在不同Ca2+浓度下的纳米结构
图2 LMP和Ca2+的结合机理[20,33]
Fig.2 The combination mechanism of low methoxyl pectin and calcium ions
在实际应用中,经常存在Ca2+添加量过大而导致凝胶脱水收缩、凝胶质地不均匀等现象,可在胶凝前向果胶溶液中加入适量的柠檬酸盐、多聚磷酸盐等Ca2+螯合剂,从而降低Ca2+的有效浓度,一定程度上缓解过高的Ca2+添加量对LMP凝胶的不利影响。此外,有报道显示,不同的Ca2+添加方式也会影响LMP的凝胶性质。Ca2+添加方式主要包括外部法和内部法[20]。外部法是指直接将LMP溶液置于高浓度的Ca2+溶液中透析,Ca2+逐渐渗透至LMP溶液中和果胶分子结合形成凝胶网络。内部法是指将Ca2+或易溶性钙盐直接加入LMP溶液中,使Ca2+均匀分散,然后诱导凝胶形成。外部法形成凝胶的快慢取决于Ca2+的扩散速率,最先与Ca2+接触的外缘LMP首先形成网络,阻碍了Ca2+向LMP溶液的中心位置扩散。因此,采用外部法制备的凝胶质地均一性较差,食品生产中较少使用。内部法具有成胶速度快、方便操作等优点,实际应用采用较多。但需要注意的是,采用内部法也可能出现不均匀的凝胶结构。例如,当LMP胶凝速率过快时,添加Ca2+的同时就诱导LMP交联,出现预凝胶颗粒,此时可通过增加LMP溶液温度、降低Ca2+浓度的方法避免预凝胶现象。再者,还可将钙盐预先溶解于少量蔗糖溶液中,然后将蔗糖溶液添加至LMP溶液中。
2.2.1.2 其他金属离子浓度
除Ca2+外,其他金属离子也可促进LMP凝胶的形成。一价阳离子虽然不能直接与2个解离的羧基基团结合形成钙桥,但可起到静电遮蔽作用,有助于果胶分子相互靠近形成氢键[34]。例如,在弱酸性环境中,Na+就可以诱导豆腐柴叶果胶发生凝胶化,凝胶可以倒置于试管中不从底部流出,最佳的Na+添加浓度为0.6 mol/L[35]。Mg2+也能和解离的羧基基团结合形成分子间交联,从而诱导凝胶形成。但与Ca2+相比,Mg2+对LMP的胶凝诱导能力较弱,成胶时需要更高的果胶浓度,且胶凝速率缓慢,形成的凝胶柔软、粘口,原因可能是Mg2+半径小于Ca2+,因此形成的钙桥稳定性较弱[36]。此外,Zn2+和Cu2+也可诱导LMP形成凝胶,在添加Zn2+和Cu2+的同时凝胶即可形成,胶凝速率过快,导致成胶不均匀且伴随着脱水现象。
虽然三价阳离子(如Al3+和Fe3+)电荷密度更高,但对LMP没有明显的胶凝诱导效果,在添加Al3+和Fe3+时,LMP分子聚集速率过快,难以发生胶凝化,果胶分子多以絮状沉淀的形成存在,这也是盐析法沉淀果胶的常用工艺。这些报道可能表明,LMP胶凝速率与金属离子之间存在一定规律,同价元素随离子半径增大而胶凝速率加快,对于同周期元素,三价阳离子对LMP的分子聚集诱导速率大于二价。在实际应用中,考虑到Ca2+在食品中广泛存在,因而多以Ca2+调控LMP的凝胶特性。
2.2.2 pH值
pH值对LMP胶凝行为的影响分为两方面[37-38]。首先,随着pH升高或降低,果胶分子羧基基团解离程度发生变化,进而影响解离的羧基基团的数目。例如,当pH值较低时(pH ~3.5),部分羧基基团以非解离的形式存在,此时虽然分子间静电斥力较小,利于果胶形成分子间氢键,但不利于果胶分子和Ca2+结合。随pH值升高,解离的羧基基团的数目增加,此时果胶分子与Ca2+能形成更多的离子交联。一般情况下,当pH>4.5时,绝大多数的羧基基团均以解离的形式存在。此外,需注意的是,当pH值过高时(如pH>7),果胶分子容易发生去甲酯化反应和β-消除反应,导致果胶DE和分子质量降低。DE降低使得果胶分子中解离的羧基基团数目进一步增加,能结合更多的Ca2+,但分子质量降低不利于果胶凝胶网络形成。此前有报道指出[39],去甲酯化反应和β-消除反应总是同时发生,温度较高且碱性相对较低的条件下,β-消除反应占据主导,温度较低且碱性较高的条件下,去甲酯化反应占主导。这也是采用碱法将HMP脱酯改性为LMP的常用方法。
如上所述,pH主要是通过改变体系中有效Ca2+的浓度和果胶分子中解离的羧基数目,从而影响果胶分子和Ca2+的交联。HAN等[40]报道显示,采用磷酸盐和柠檬酸盐缓冲液调节果胶pH值时,凝胶强度在pH 4.0时最大,随pH值升高,凝胶强度迅速降低,在接近pH 7.0时甚至不能形成凝胶。原因可能是磷酸根基团或柠檬酸根基团优先络合Ca2+,降低了果胶溶液中游离的Ca2+浓度。YANG等[39]采用NaOH调节pH,可将LMP凝胶的pH范围拓宽至3.5~9.5,发现在pH 8.5时,凝胶强度最高,原因是果胶分子在碱性条件下发生了脱酯反应,使得更多的羧基基团可以和Ca2+结合。但当pH>8.5时,β-消除反应明显,使得果胶分子解聚,从而降低了凝胶强度。值得注意的是,虽然采用NaOH调节果胶pH时,添加的CaCl2可能和氢氧根离子形成Ca(OH)2,但整体而言,Ca(OH)2属于微溶性钙盐,20 ℃时溶解度为160 g/L,仍然可以提供足够游离的Ca2+和果胶结合。实际应用中,可根据具体的要求选择合适的pH调节策略。
2.2.3 蔗糖浓度
虽然LMP胶凝时不需要添加蔗糖作为脱水剂,但适量浓度的蔗糖可以明显提高LMP的凝胶强度[41]。这是因为蔗糖具有很强的亲水性,能够优先于果胶分子和水结合,降低果胶的溶剂化程度,从而促进果胶分子彼此结合形成额外的氢键[42]。然而,当蔗糖浓度过高时,果胶分子的溶剂化程度越低,分子构象更紧密,反而不利于LMP和Ca2+结合。此外,过多的蔗糖和水分子结合后,会剥夺果胶凝胶网络结构中的水分,导致凝胶皱缩。HAN等[40]报道了不同蔗糖浓度下苹果LMP的凝胶性质,发现随蔗糖浓度升高,果胶的凝胶强度也不断增加,在蔗糖含量为40%时达到最高值,此后继续增加蔗糖浓度凝胶强度则开始下降,凝胶外观也逐渐粗糙。其他可溶性固形物如葡萄糖、果糖等也可以起到与蔗糖相似的作用,作用原理相同。
另外,蔗糖添加对LMP的凝胶质地有也较大影响。不添加蔗糖时,LMP凝胶颜色很浅、不透光,但加入少量蔗糖后,凝胶透光性增加、表面更光滑、凝胶色泽加深。再者,由于蔗糖本身具有良好的亲水性,因此加入蔗糖后,LMP凝胶的持水性也可得到改善,凝胶质地更富有弹性。一般而言,制备LMP凝胶时,蔗糖添加量多为5%~30%,过高的蔗糖不仅增加了LMP凝胶的热量,也降低了凝胶性质。
2.2.4 温度
温度对LMP的胶凝也有明显影响。温度较高时,果胶分子在溶液中移动速率较快,难以和Ca2+结合形成稳定的交联区,温度降低时,果胶分子运动速率较慢,容易和Ca2+结合。但是当温度低于一定值以后,添加Ca2+的同时凝胶化随即发生,导致体系形成预凝胶颗粒,严重影响凝胶质地[43]。因此,制备LMP凝胶时,常将钙加入热的果胶溶液中,使Ca2+均匀分散,之后冷却果胶体系以便形成质地均一的凝胶。另一方面,虽然果胶分子和Ca2+的结合是引起LMP凝胶形成的主要因素,但果胶分子间的氢键作用也起到稳定凝胶网络的作用[44]。因而,当温度降低时,氢键作用越强,凝胶强度也越高。
2.2.5 时间
时间也是影响LMP凝胶形成的重要因素。如上所述,当温度较高时,果胶分子和Ca2+的结合较慢,此时胶凝速率也相对较低,需要更长的时间才能形成稳定的凝胶网络结构。当温度较低时,果胶和Ca2+的结合相对容易,因此在较短的时间内就能形成凝胶网络。另外,LMP在刚刚形成凝胶后的短时间内还不能形成稳定的“蛋盒”结构,此时果胶分子、Ca2+、水分子和蔗糖之间的相互作用仍处在动态的平衡中,大致在凝胶形成后48 h后才能实现稳定的凝胶结构[45]。然而,保存时间过长时,又可能出现凝胶网络收缩。值得一提的是,GUO等[46]报道了假酸浆LMP在Ca(OH)2诱导下的胶凝行为,发现假酸浆果胶在添加少量Ca(OH)2时,室温静置20~30 min即可形成凝胶,证实了时间对LMP胶凝过程的重要作用。
2.2.6 其他因素
除上述因素外,其他因素[47-48](如糖醇浓度、其他聚合物存在与否等)也可能对LMP的胶凝化有明显影响。虽然目前有关这方面的报道十分有限,但考虑到和Ca2+的结合是引起LMP胶凝的主导因素,因而可以推断,当外界因素有利于促进果胶和Ca2+结合时,就有利于LMP的胶凝。相反,当外界因素阻碍果胶分子和Ca2+的结合时,凝胶化就受阻。
3 LMP的保健功能
果胶是水溶性的膳食纤维,不被人体分泌的消化酶水解,但能被人体肠道内的微生物利用,产生短链脂肪酸。果胶已被证实具有明显的健康功效,包括缓解肠道炎症、调控新陈代谢紊乱、优化肠道菌群、预防癌症、降低肥胖风险等。其中,果胶分子的结构特点,如DE、分支化程度、分子质量等,对其健康功效影响显著。
3.1 新陈代谢调控
长期摄入过多的卡路里会增加总胆固醇、甘油三酯、低密度脂蛋白胆固醇、高密度脂蛋白胆固醇的水平,进而诱导胰岛素抵抗,导致肥胖症、二型糖尿病、高血压、非酒精性脂肪肝等疾病。众多研究表明,摄入果胶可有效预防和缓解这些疾病,其机制主要包括三点:(1)果胶能一定程度上扰乱消化酶在人体肠道内的功能,结合胆固醇和胆汁酸,从而阻止胆固醇吸收;(2)果胶高度亲水,可降低葡萄糖吸收和肠道激素的分泌,从而下调了胰岛素水平;(3)果胶在大肠内被肠道微生物发酵,产生短链脂肪酸,如醋酸盐和丙酸盐,进而抑制肝脏胆固醇合成。果胶的这些调控效果高度依赖于其结构特点。例如,CHOI等[49]研究发现,富含RG-I型的果胶更利于缓解高脂饮食诱导的肥胖小鼠体重增加、降低小鼠的胰岛素抵抗。此外,有研究比较了酯化程度对果胶健康功效的影响,结果发现,与DE为35%的低酯果胶相比,摄入DE值为70%的柑橘和苹果果胶更利于降低低密度脂蛋白水平。
3.2 缓解炎症
与不溶性的膳食纤维相比,水溶性的膳食纤维在缓解肠道炎症方面更具优势。POPOV等[50]研究发现,果胶主要通过降低中性白细胞的黏附性和抑制氧自由基的产生达到降低炎症的效果,且进一步研究显示,摄入果胶可显著改善小鼠的结肠炎。此外,与HMP相比,LMP对乙酸和脂多糖诱导的胃肠道损伤有更好的缓解作用,表明LMP的炎症调控效果优于HMP。就分支化程度而言,有报道显示,分支化程度较高的果胶具有更好的炎症调控效果。
3.3 预防癌症
MAXWELL等[51]报道,甜菜皮果胶能显著诱导HT29癌症细胞凋亡,且RG-I型结构含量越多、DE越低,效果越好。然而,也有研究表明,对柑橘果胶而言,RG-II型区域含量越高、果胶分子质量含量越低,对Caco-2细胞增殖的抑制作用就越好。
3.4 改善肠道菌群
近年来,诸多研究表明,果胶能明显改善肠道菌群的多样性、并增加有益菌群的丰度,从而利于恢复异常的肠道菌群。JIANG等[52]研究发现,果胶干预能复原肥胖小鼠的肠道菌群,使之达到和正常小鼠相似的水平,表明果胶对肥胖诱导的肠道菌群异常有显著的调控作用。ZHU等[4]研究了分支化程度不同的柑橘果胶对肥胖小鼠的干预效果,结果发现,分支化程度高的果胶显著降低了肥胖小鼠的体重增加、抑制了胰岛素抵抗及炎症反应,对肠道菌群和脂质代谢的调控效果明显优于分支化程度低的果胶。此外,GHAFFARZADEGAN等[53]研究显示,HMP更能刺激肥胖小鼠肠道中乙酸盐和丙酸盐的生成,维持乳酸杆菌的活力,效果高于LMP。
4 LMP在食品中的应用
虽然当前尚无证据表明LMP比HMP具有更优良的保健效果,但就整体而言,果胶的健康功效已得到广泛认可。因而,果胶在食品中并无最大添加限度,具体添加量取决于食品生产时的工艺和食品感官、质构等要求。由于在Ca2+存在的条件下,LMP在有糖或无糖的环境中均能形成凝胶,这种特点使得LMP被广泛用于低糖、低热量、低甜度食品的开发,如低糖果酱、果冻、软糖、果汁、酸奶、冷冻甜点等。
4.1 低糖果酱
LMP在果酱中的应用最为常见。由于HMP需要在高糖条件下才能形成凝胶,因此制备的果酱都具有较高的含糖量[54],而LMP仅在Ca2+存在时就能形成凝胶,不受糖含量的影响。而且与HMP凝胶相比,LMP凝胶有一定的可逆性,经加热或搅拌后,可以转变为流体状态,冷却或停止搅拌后又可以恢复为凝胶状,具有优良的可涂抹性[55-56]。
4.2 带肉果汁
带肉果汁同时包含液态的果汁和固态的果肉,贮藏中容易出现果汁和果肉的分离,严重影响产品外观。为保证货架期内果汁和果肉能充分融合、不出现相分离,需要添加合适的稳定剂以提高该果汁体系的稳定性。传统饮料的稳定剂一般选择海藻酸钠等多糖,但存在果汁假塑性差、腥味大、浊度高等缺点。相比之下,LMP作为稳定剂使用时,不仅能与饮料中自身含有的金属离子产生增稠或胶凝作用,实现饮料的稳定,同时也赋予了饮料“丝滑”、“稀薄”的口感,且不存在腥味残留等缺点[57]。
4.3 低酸性软糖
传统的HMP凝胶软糖大多口味较酸,风味单一,且大量的糖分会降低体系的水分活度,冷却时果胶胶凝速率过快,致使生产出的糖果黏性较高。与HMP相比,LMP可以在较高的pH环境下形成凝胶,近年来LMP已经逐渐替代HMP用于低酸性软糖的生产[58]。生产LMP软糖时,常将LMP和淀粉结合使用,用于控制胶凝速率和降低糖果黏性。
4.4 凝固型酸奶
在凝固型酸奶的生产中,LMP已可作为优良的稳定剂广泛应用。LMP的主要单糖组成之一是半乳糖醛酸,因此LMP溶于水后携带负电荷,溶液具有一定酸性。加入乳酸饮料后,LMP能和带正电荷的蛋白质颗粒结合,干扰蛋白质自身在酸性条件下的聚集,同时使形成的LMP-蛋白质复合颗粒带负电荷,从而相互排斥,实现体系的稳定[59]。但由于LMP价格相对较高,因此在实际生产中,一般将LMP与羟甲基纤维素按1∶1的比例混合使用,不仅降低了生产成本,而且又可利用两者的协同效应进一步提高体系的稳定性。
4.5 冰淇淋
传统冰淇淋生产工艺中大多采用明胶作为增稠剂,但明胶形成的凝胶口感较硬、透光性差,会影响冰淇淋的品质。考虑到冰激凌包含较高浓度的可溶性固形物,因而LMP可在较低温度下形成凝胶[60]。基于这一性质,LMP已被用于冰淇淋等冷冻甜点的加工生产,而且LMP形成的凝胶柔软可口、透光性较好、质地与冰淇淋相协调,同时风味释放特性优良。
4.6 其他产品
除上述几类食品外,LMP形成的凝胶也可作为脂肪替代物用于干酪和蛋糕的生产[61]。此外,LMP还可增加甜食、焙烤制品的光泽度。特别是,LMP属于水溶性膳食纤维,其自身不仅对人体有良好的保健功能,而且近年来LMP在包埋益生菌等功能成分方面的潜力也得到了广泛关注[62],为LMP功能食品的开发提供了新思路。
5 结论
LMP和Ca2+的结合是诱导凝胶形成的主导因素,该过程不仅受LMP自身分子结构特点的影响,也受到外界环境因素的作用。无论是结构因素还是环境因素,它们影响LMP胶凝化的本质在于影响了果胶分子和Ca2+的结合过程,宏观表现为不同的胶凝速率、不同的凝胶理化性质。实际应用LMP时,需根据具体的需求合理选择LMP类型及凝胶形成调节。本文通过总结LMP的胶凝机理及影响其凝胶性质的常见因素,并列举了LMP在新型食品开发中的应用实例,可为LMP在食品工业中的进一步应用提供参考。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



