混菌发酵制备茶籽多肽及其抗氧化作用
小分子多肽是蛋白质不完全水解后产生的由不同氨基酸组成的多肽链的通称,相对分子质量在5 000以下,具有比原料蛋白及氨基酸混合物更优越的食品加工性能及营养价值,也被称为“生物活性肽”。多肽相比蛋白质更易吸收,同时具有降胆固醇、降血压、抗菌、抗氧化等生物活性,广泛应用于医药、保健、食品、化妆品等行业[1-2]。多肽的制备可采用酸碱水解、微生物发酵转化及蛋白酶水解等方法,发酵法制备生物活性肽正成为肽制备工艺的研究热点[3]。该方法利用单菌或混菌微生物生长过程中产生的蛋白酶水解蛋白原料,通过对发酵过程的控制,定向产生具有特定生物功能的小分子多肽产物,具有成本低、无污染等特点。众多学者在发酵菌种选育、发酵过程控制等方面开展了研究,已成功开发出大豆肽[4]、花生肽[5]、紫苏肽[6]、榛仁肽[7]等多种生物活性肽。衰老、炎症、肿瘤等疾病的发病机理与体内自由基过多或清除自由基能力下降有密切关系。植物蛋白来源的天然抗氧化肽多样性广、生物安全性高,在功能性食品、生物医药开发领域具有广阔的应用前景。抗氧化活性评价方法较多,其中ABTS阳离子自由基、DPPH自由基、羟自由基(·OH)被广泛用于抗氧化多肽的自由基清除能力评价[8-10]。根据自由基类型、自由基清除机制的不同,以上三者可分别评估脂溶性、水溶性抗氧化剂的氮、氧自由基的清除能力,综合采用以上3种测定方法可弥补单一方法的不足,更科学、全面地评价多肽抗氧化能力[11]。
茶籽是山茶科植物茶的果实,是茶叶生产的副产物,除部分可留作茶树有性繁殖种子及压榨茶油外,目前尚无成熟的利用途径,被散落在茶园中,任其自然腐化。茶籽中富含10%~15%的茶皂素、10%~20%的蛋白质、30%~50%的糖类物质和一定量的多酚类物质。茶叶源蛋白、茶籽源多肽的研究及产品开发是继茶皂素、茶多酚、茶多糖等活性成分之后又一新热点[12-13]。现已相继证实了茶叶、茶渣、茶籽中的蛋白质组分及其多肽水解产物不同程度上具备抗氧化活性[14-15]、血管紧张素转换酶(angiotensin I-converting enzyme,ACE)抑制活性[16]、降糖活性[17]。相对大豆、花生、玉米等来源的多肽而言,茶籽源多肽的制备及产品开发目前尚处在分离提取及活性评价的初级研究阶段。
本研究以茶籽为原料,采用两段顺序发酵工艺,首先以白腐真菌灵芝菌的菌丝体增殖对茶籽原料中的蛋白质组分进行有效释放,进而以解淀粉芽孢杆菌完成茶籽蛋白的生物转化,制备茶籽多肽。基于Plackett-Burman(PB)试验设计获得影响多肽产量的显著因子后,设计多因素响应面试验,得到茶籽多肽的最佳发酵工艺。并对发酵后产物进行超滤分离及抗氧化活性分析,为茶叶籽、油茶籽、油茶饼粕资源的高值化利用及茶籽多肽产品开发提供技术参考。
1 材料与方法
1.1 材料
茶籽原料采自安徽宣城地区的秋季茶园,经干燥、脱壳、粉碎预处理后,备用;灵芝菌(Ganoderma lucidum UIM-281),解淀粉芽孢杆菌(Bacillus amyloliquefaciens PI142)为本实验室前期诱变选育的保存菌种,分别具备木质素分解能力及蛋白酶分泌能力。
灵芝菌增殖培养采用马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基;解淀粉芽孢杆菌增殖培养采用LB培养基;混菌发酵培养基组成为:茶籽粉70 g,葡萄糖4 g,蒸馏水1 L,pH 8.0。
1.2 试剂与设备
DPPH、ABTS、牛血清白蛋白,上海阿拉丁生化科技股份有限公司;水杨酸、氢氧化钠、酒石酸钾钠、无水乙醇等均为分析纯,国药试剂。Multiskan FC酶标仪,赛默飞世尔仪器有限公司;TGL-16A高速冷冻离心机,湖南湘仪;WKF-180高速粉碎机,淄博史克制药设备有限公司;ZQZY-78BV恒温振荡培养箱,上海知楚。
1.3 试验方法
1.3.1 发酵剂制备
灵芝菌种子培养:从保存的平板上,切取直径1 cm的UIM-281菌丝1块,打散后接入PDA培养基中,28 ℃,160 r/min的条件下振荡培养72 h,作为种子液。解淀粉芽孢杆菌种子培养:从保存的菌种斜面挑取1环PI142接至含30 mL LB培养基的250 mL锥形瓶中,28 ℃、200 r/min振荡培养12 h,作为PI142种子液。
1.3.2 混菌两段发酵工艺流程
混菌两段发酵工艺流程如下:
茶籽预处理(干燥、脱壳、粉碎至60目)→发酵培养基调配(主料茶籽、辅料葡萄糖)→接种UIM-281(装液量100 mL/250mL)→Ⅰ段发酵→接种PI142→Ⅱ段发酵→离心(10 000 r/min,10 min)→取上清液、粗分离→茶籽多肽
1.3.3 混菌发酵培养条件主效应因子筛选
基于前期UIM-281、PI142单因素发酵试验结果,设计Plackett-Burman试验对影响茶籽多肽产量的众多因素进行显著性筛选。入选的因素为:主料茶籽粉、辅料葡萄糖、UIM-281接种量、初始pH、Ⅰ段发酵温度、Ⅰ段发酵时间、PI142接种量、Ⅱ段发酵温度、Ⅱ段发酵时间、摇床转速。每个因素取高(+1)、低(-1)两水平。基于PB试验结果,设计最陡爬坡实验,对主效应因子进行水平寻优。
1.3.4 响应面优化试验
根据PB试验和最陡爬坡试验结果,选取主效应因子为自变量,以多肽产量为响应值,设计三因素三水平响应面试验。
1.3.5 多肽含量测定
多肽含量以酸可溶性多肽计,采用三氯乙酸法测定。
标准曲线制作:标准曲线采用双缩脲法,以牛血清白蛋白的质量浓度为横坐标,OD值为纵坐标,制作标准曲线y=0.009 5x+0.108 7,R2=0.998 9。
样品测定:发酵液经离心分离后,取5 mL上清液,加入5 mL 质量分数10%的三氯乙酸,充分混匀后,静置10 min,8 000 r/min离心10 min,去除大分子蛋白,取上清液,采用双缩脲法测定多肽含量,代入标准曲线,计算多肽含量。
1.3.6 茶籽多肽粗分离
发酵液经固-液离心分离后,上清液加入2倍体积的无水乙醇,静置沉淀12 h后,8 000 r/min离心10 min,去除大分子蛋白、多糖等组分;对离心后的上清液,采用杯式超滤器,选择截留分子质量5、1 kDa的平板式超滤膜片在流速10 mL/h、压力0.3 MPa条件下对小分子多肽组分进行粗分离,获得分子质量1~5 kDa的肽段(Ts),测定其抗氧化活性。以未经接种发酵的茶籽培养基上清液(T0)为对照;L-抗坏血酸(维生素C)为阳性对照。
1.3.7 ABTS阳离子自由基清除率测定
参考郝金斌等[8]的方法稍加修改,将7 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液等体积混合,室温下暗处放置12~16 h,将其用无水乙醇稀释成在734 nm处吸光值达到0.7±0.02,得ABTS阳离子溶液。将200 μL不同浓度的样品液与800 μL ABTS阳离子溶液充分混匀,置于暗环境准确计时6 min,在734 nm处测吸光值, ABTS阳离子自由基清除率计算如公式(1)所示。以与样品同一质量浓度的L-抗坏血酸作阳性对照,以质量浓度与ABTS阳离子自由基清除率之间做回归方程并且计算半抑制浓度(half maximal inhibitory concentration,IC50)。
ABTS阳离子自由基清除率![]()
(1)
式中:A0,无水乙醇替代样品的吸光值;A1,添加样品的吸光值;A2,无水乙醇替代ABTS溶液的吸光值。
1.3.8 DPPH自由基清除率测定
参考王婕娉等[9]的方法稍加修改,精确称取2 mg DPPH,以无水乙醇定容至25 mL,放置时间不要超过4 h,得DPPH溶液。将200 mL不同浓度的样品液和400 μL DPPH溶液混合均匀,置于避光的环境中反应30 min后,在517 nm处测定吸光值,DPPH自由基清除率计算如公式(2)所示。以与样品同一质量浓度的L-抗坏血酸作阳性对照,以质量浓度与DPPH自由基清除率之间做回归方程并且计算IC50。
DPPH自由基清除率![]()
(2)
式中:A0,无水乙醇替代样品的吸光值;A1,添加样品的吸光值;A2,无水乙醇替代DPPH溶液的吸光值。
1.3.9 ·OH清除率测定
采用水杨酸-硫酸亚铁法,参照许继业等[10]的方法稍加修改,反应体系中依次加入9 mmol/L 水杨酸-乙醇、9 mmol/L FeSO4、不同浓度的样品溶液及8.8 mmol/L H2O2各1 mL,各组分37 ℃恒温水浴反应15 min后,在510 nm处测定反应液的吸光度值,·OH 清除率计算如公式(3)所示。以与样品同一质量浓度的L-抗坏血酸做阳性对照,以质量浓度与·OH 清除率之间做回归方程并且计算IC50。
·OH清除率![]()
(3)
式中:A0,去离子水替代样品的吸光值;A1,添加样品的吸光值;A2,去离子水替代H2O2溶液的吸光值。
1.3.10 数据统计与分析
每个试验重复3次,结果取平均值。利用Minitab 18.0、Design expert 10.0、GraphPad prime 9.0进行试验设计及数据分析,P<0.05 表示达到显著性差异水平。图表采用OriginPro 2019b绘制。
2 结果与分析
2.1 混菌两段发酵主效应因子筛选
以发酵液中茶籽多肽产量为指标,对影响两段发酵过程的诸多因素进行筛选,Plackett-Burman试验设计及结果如表1所示,各因子对茶籽多肽产量的显著性分析如表2所示。从表2可以看出,备选的10个因素均对茶籽多肽的产量呈现正效应影响,其中主料茶籽粉、初始发酵pH及Ⅰ段发酵温度达到显著水平(P<0.05),是影响茶籽多肽产量的主效应因子。因此,选定此3个因素作为下一步响应面试验的优化因素。
表1 PB试验设计及结果
Table 1 Plackett-Burman experimental design and results

2.2 最陡爬坡试验
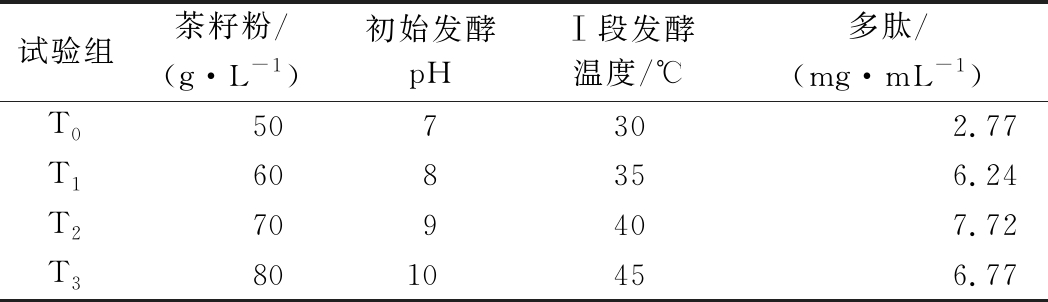
由表2可知,茶籽粉、初始发酵pH及Ⅰ段发酵温度3个因素均呈显著正效应,需要进行爬坡试验以确定各因素的最陡上升路径和最高取值水平。爬坡试验以各因素的PB试验中心点开始,沿3个因素取值增加的方向移动。从表3可以看出,当茶籽粉70 g/L、初始发酵pH 9.0、Ⅰ段发酵温度40 ℃时,多肽产量有明显跃升,达到7.72 mg/mL,此后开始回落,因此选择T2组对应的各因素的水平值为后续优化试验的中心点,设计响应面优化试验。
表2 PB试验设计因子水平及影响因子的显著性分析
Table 2 Factors levels and significance analysis of Plackett-Burman
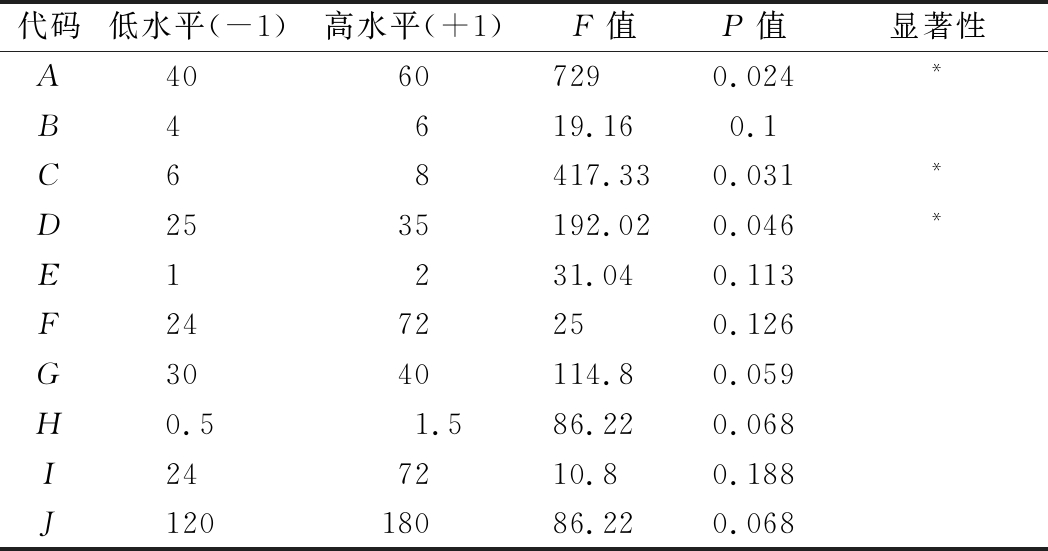
注:*表示差异显著(P<0.05)
表3 最陡爬坡试验结果
Table 3 Experimental design of steepest ascent and corresponding results
2.3 响应面优化茶籽多肽发酵条件
基于PB试验及最陡爬坡试验结果分析,选定茶籽粉(X1)、初始发酵pH(X2)、Ⅰ段发酵温度(X3),设计三因素三水平Box-Behnken试验,进行多因素试验优化,因素及水平见表4。通过对表5数据进行二次多项回归拟合,得到茶籽粉、初始发酵pH、Ⅰ段发酵温度与茶籽多肽产量(Y)关系的回归模型:Y=8.73+0.93X1+0.81X2+0.11X3-0.025X1X2-X1X3-0.042X2X3-0.90X12-1.99X22-1.33X32。
表4 Box-Behnken设计因子及水平
Table 4 Factors and levels of Box-Behmken design

表6为回归模型方差分析。从表6可知,该模型P=0.005 6,失拟项P=0.600 9,相关系数R2=0.963 7,说明该回归模型极显著,失拟项不显著,拟合程度良好,误差小,可以用此模型对茶籽多肽的发酵进行预测。模型中X1、X2、X12、X22、X32对Y值的影响均达到或超过显著水平,说明三因素对多肽产量的影响不是单纯的线性关系,其各自的二次项也存在显著影响;其影响效果为茶籽粉>初始发酵pH>Ⅰ段发酵温度,其中茶籽粉、初始发酵pH均达到极显著水平。
表5 Box-Behnken设计及结果
Table 5 Result and design of Box-Benhmken
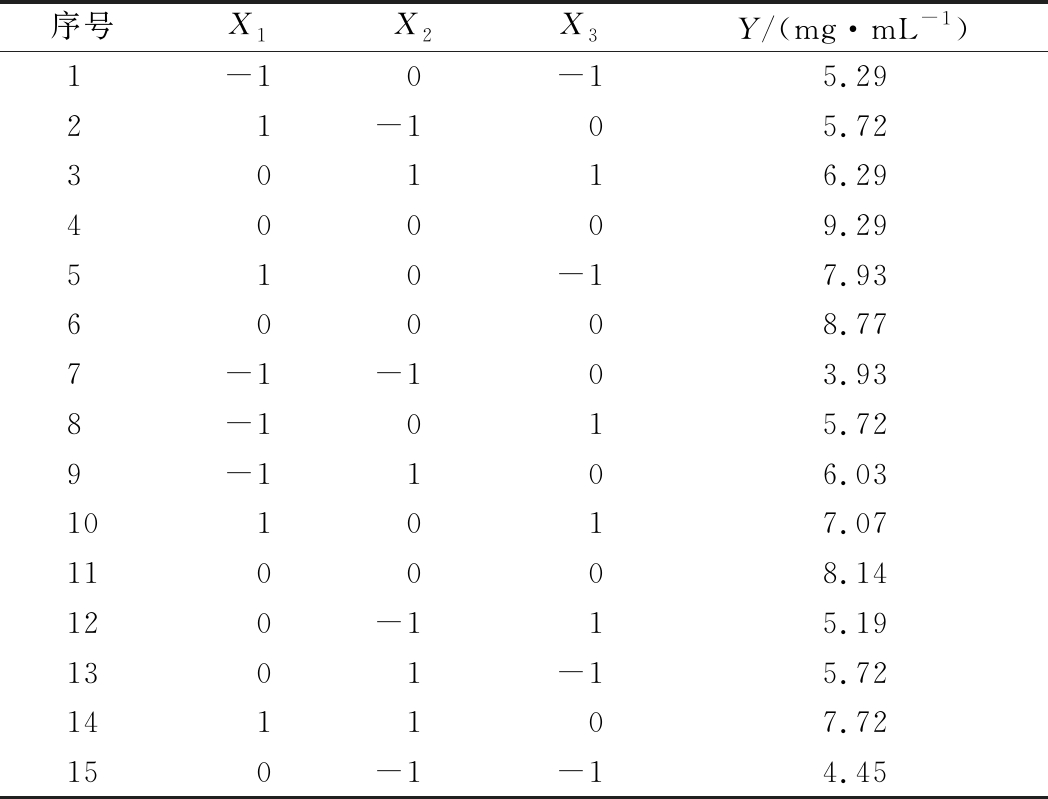
表6 Box-Behnken设计方差分析
Table 6 Analysis of variance(ANOVA) analysis of Box-Behnken
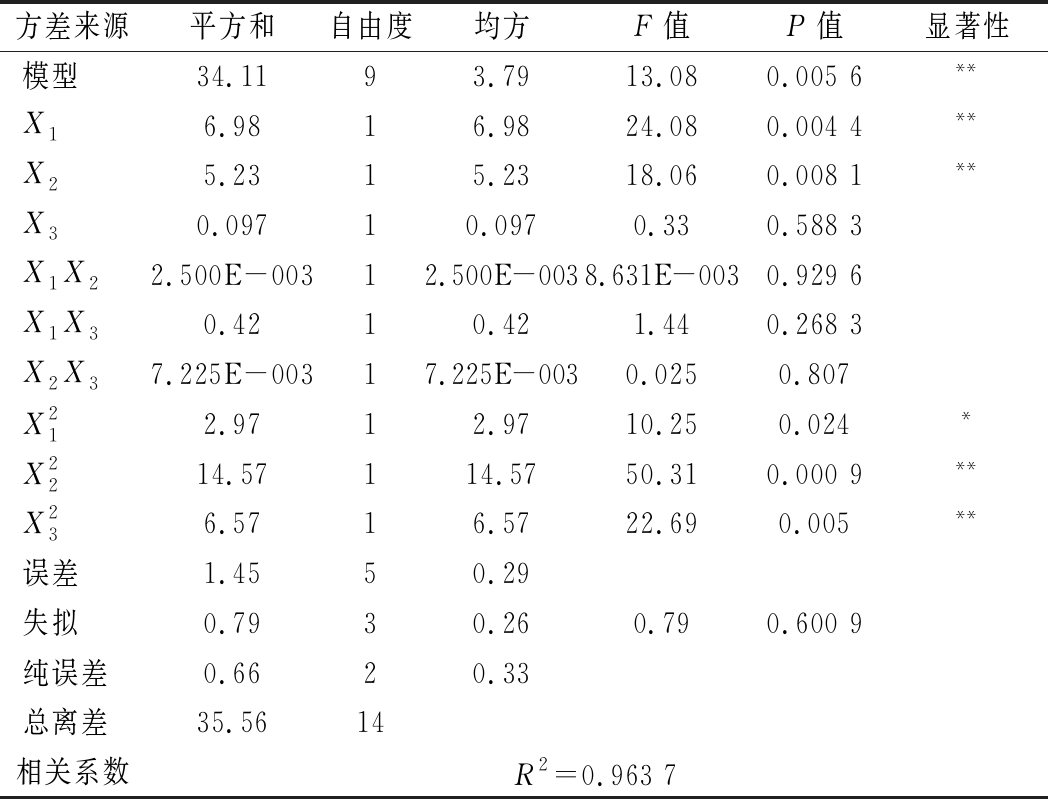
注:**表示差异极显著(P<0.01)
对以上三因素作响应面图,从图1可以看出,在所选变量区域内,茶籽多肽产量存在极大值。回归方程求解后,得到三因素的最优值为:茶籽粉75.23 g/L、初始发酵pH 9.20、Ⅰ段发酵温度39.87 ℃(取值40 ℃),结合前期单因素试验及PB试验各因素的取值水平,确定优化的发酵条件为:茶籽粉75.23 g/L、葡萄糖4.0 g/L、UIM-281接种量1%、初始发酵pH 9.20、Ⅰ段发酵时间24 h、PI142接种量0.5%、Ⅱ段发酵时间24 h、两段发酵温度恒定40 ℃,摇床转速120 r/min。在该条件下,进行3次重复验证实验,得到茶籽多肽的实际产量为8.97 mg/mL,接近理论最大理论预测值9.06 mg/mL,表明该模型可以较好地指导茶籽多肽的混菌发酵生产。
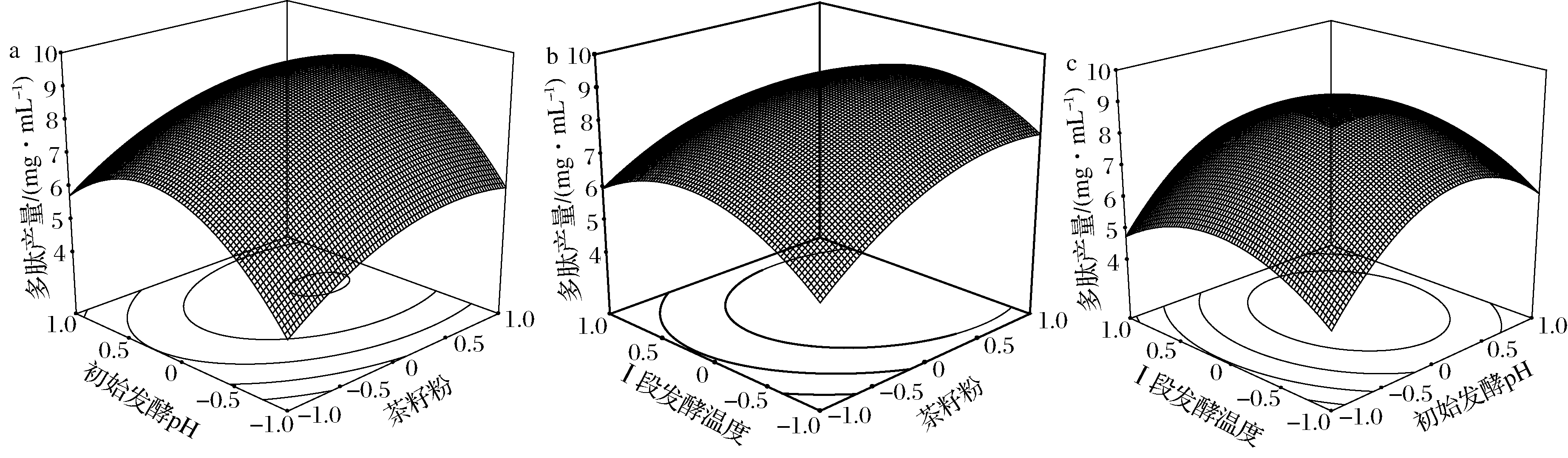
a-初始发酵pH和茶籽粉;b-I段发酵温度与茶籽粉;c-I段发酵温度与初始发酵pH
图1 茶籽粉、初始发酵pH、I段发酵温度间交互影响的响应面图
Fig.1 Response surface diagram of tea seed concentration, initial pH and the first stage temperature
2.4 茶籽多肽的抗氧化活性
2.4.1 ABTS阳离子自由基清除活性
未发酵茶籽T0、发酵后茶籽多肽Ts及维生素C的ABTS阳离子自由基清除效果如图2所示。T0、Ts对ABTS阳离子自由基清除活性存在正相关量效关系。同一浓度下,Ts的ABTS阳离子自由基清除能力显著高于T0,其ABTS阳离子自由基半抑制浓度为0.358 mg/mL,显著低于T0的IC50值0.807 mg/mL(P<0.05)。以上表明,茶籽原料经发酵水解后产生的小分子质量多肽具有更强的ABTS阳离子自由基清除能力。茶籽蛋白中富含色氨酸[18],色氨酸是环状氨基酸,含有苯环,能够为自由基提供质子,减缓自由基的链式反应,推测茶籽中的蛋白质组分经微生物分解后,暴露出更多的色氨酸残基,进而赋予其ABTS阳离子自由基高清除活力[19]。
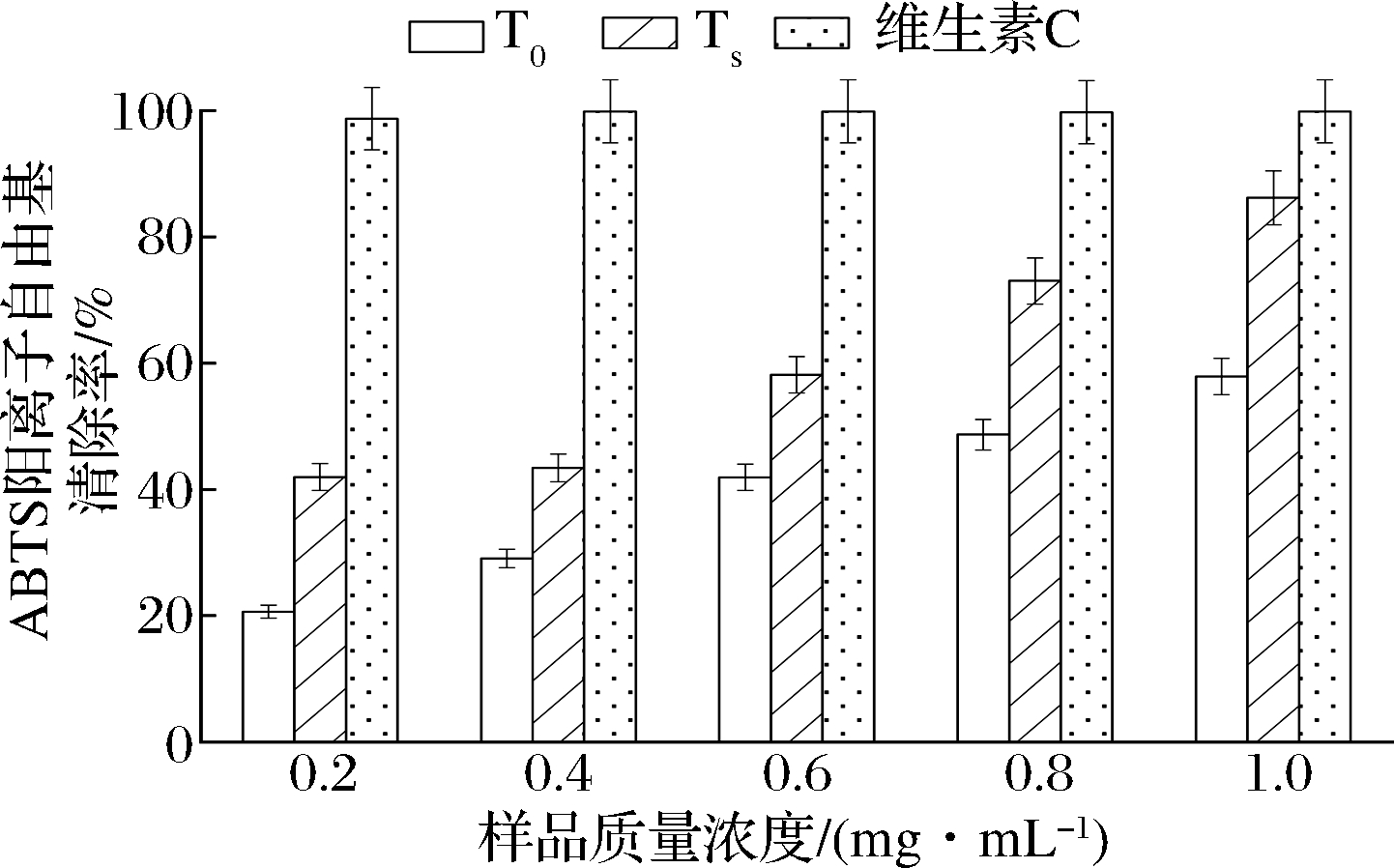
图2 不同组分对ABTS阳离子自由基清除活性
Fig.2 ABTS radical scavenging activity of different components
2.4.2 DPPH自由基清除活性
T0、Ts及维生素C对DPPH的清除能力如图3所示。DPPH清除率随T0、Ts浓度的增加而逐渐提高,不同浓度下Ts的DPPH清除率均>50%,质量浓度1 mg/mL时的最高清除率达到85.5%,显著高于T0。以质量浓度对DPPH自由基清除率做回归方程,得到T0、Ts、维生素C的IC50值分别为0.796、0.164、0.01 mg/mL,表明低分子质量茶籽多肽Ts较未发酵茶籽原料具有更强的DPPH清除能力。王南南等[14]以酶解法制备茶渣蛋白肽,获得的低分子质量肽段(<5 kDa)具有最强的DPPH自由基清除活性,与本实验结果一致。
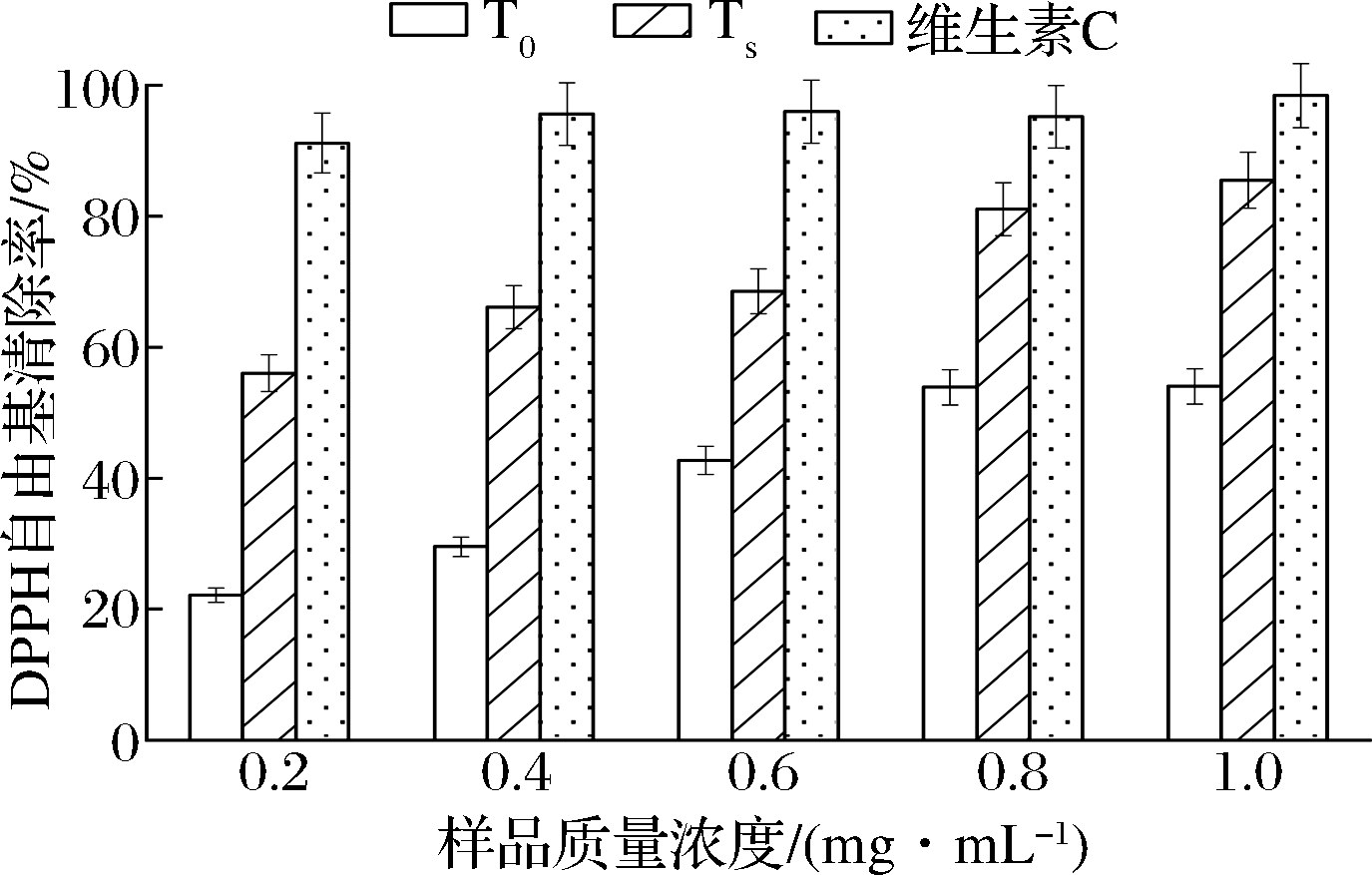
图3 不同组分对DPPH自由基清除活性
Fig.3 DPPH radical scavenging activity of different components
2.4.3 ·OH清除活性
由图4可知,相对于ABTS阳离子自由基、DPPH自由基清除活性而言,T0、Ts的·OH清除能力较弱,且整体显著低于维生素C。Ts的·OH清除率随其浓度的增加而逐渐提高,IC50值为3.537 mg/mL,显著高于同浓度下T0的·OH清除活性。推测是茶籽经UIM-281、PI142混菌发酵后,原料蛋白被水解成小分子多肽,其氨基酸组成中富含的苯丙氨酸、酪氨酸等疏水性残基,提高了其·OH清除活性[20]。
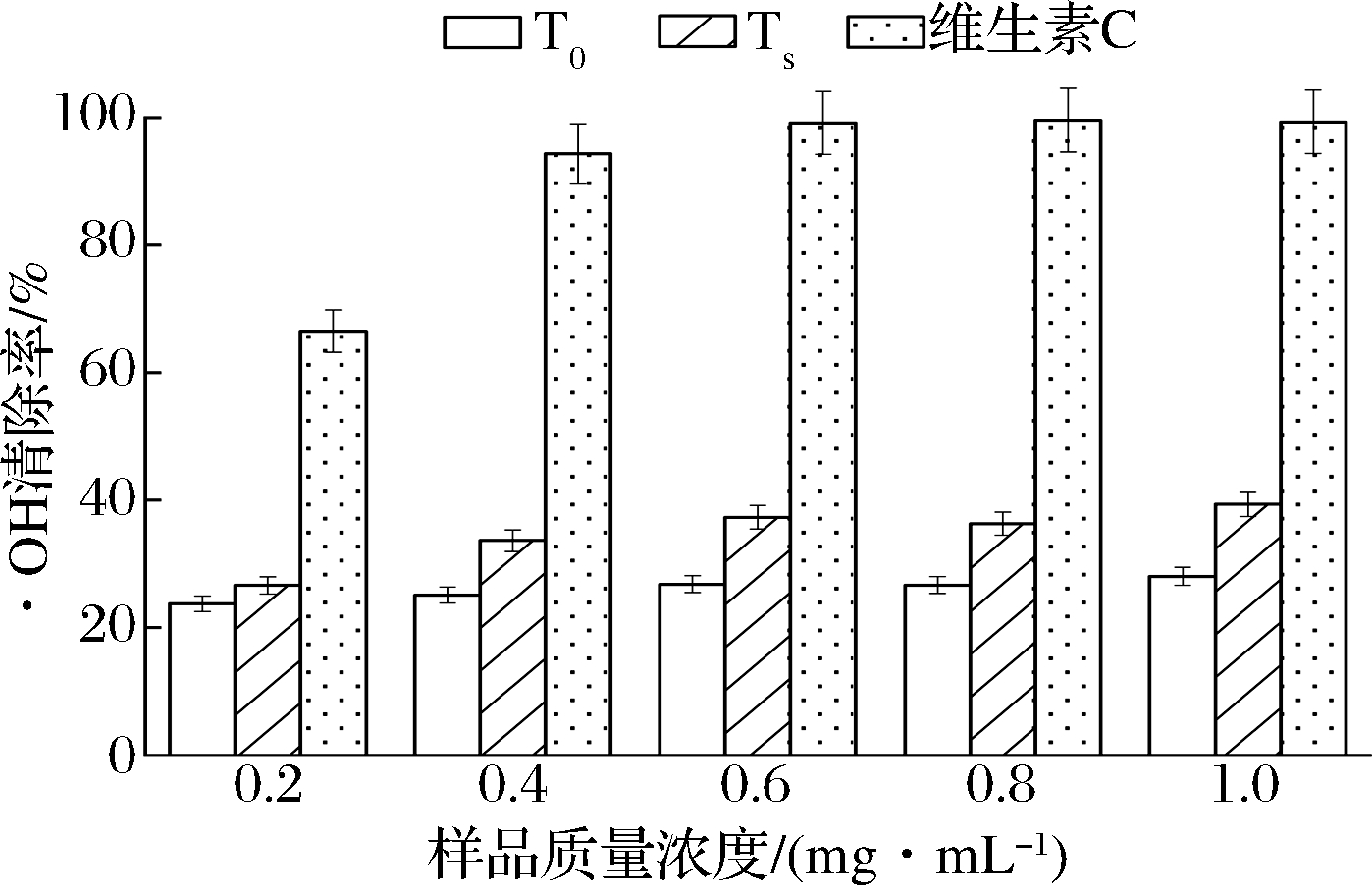
图4 不同组分对·OH清除活性
Fig.4 The scavenging activity of different components on hydroxyl radical
3 结论
以茶籽为原料,采用灵芝菌和解淀粉芽孢杆菌混菌顺序两段发酵工艺制备茶籽多肽,并对茶籽多肽产物的抗氧化活性进行研究。通过Plackett-Burman设计、最陡爬坡设计以及响应面分析试验,获得了茶籽多肽制备的回归模型和优化参数为:茶籽粉75.23 g/L、葡萄糖4.0 g/L、UIM-281接种量1%、初始发酵pH 9.20、Ⅰ段发酵时间24 h、PI 142接种量0.5%、Ⅱ段发酵时间24 h、两段发酵温度恒定40 ℃,摇床转速120 r/min,茶籽多肽产量达到8.97 mg/mL。以超滤法获得低分子质量肽段Ts的体外抗氧化能力显著优于未发酵茶籽原料,其ABTS阳离子自由基、DPPH自由基、·OH清除半抑制浓度分别为0.358、0.164、3.537 mg/mL,可为茶籽资源的高值化应用及茶籽多肽产品开发提供基础数据支持。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



