负载褐藻多酚的麦醇溶蛋白纳米递送体系的制备及特性研究
褐藻多酚(phlorotannins,PT)是褐藻中多酚化合物的总称,分子质量大多为126~650 Da的间苯三酚衍生物或聚合物[1]。PT因分子链上含有大量的酚羟基而具有抗氧化[2]、抑菌[3]、降血糖[4]等多种生物活性功能,但其对外界因素(如温度、氧气含量、光照等)敏感,容易受外界因素的影响发生聚合或缩合反应,从而导致PT生物活性降低[5]。研究表明多糖、蛋白质等食源性生物大分子作为载体可提高活性物质在食品和医药等领域的生物利用率[6-9]。CUI等[10]利用苦瓜多糖作为载体运载PT,有效地提高了其稳定性。史建如等[11]研究发现制备负载PT的纳米基具有一定的缓释效果。但未发现用蛋白作为载体提高PT的稳定性。
植物蛋白质具有良好的生物兼容性、生物可代谢性与生物降解性,因此能够在活性物质的递送系统中得到广泛的应用,如玉米醇溶蛋白,大豆分离蛋白、麦醇溶蛋白等[12]。麦醇溶蛋白是小麦中的主要蛋白质之一,约占其总蛋白含量的30%,平均相对分子质量为25~100 kDa,在70%~90%的乙醇水溶液中有良好的溶解性[13]。麦醇溶蛋白在溶剂的极性发生改变时,会通过分子内氢键、二硫键、疏水相互作用等作用力形成类似于球状的三维结构。许雪儿等[14]研究发现利用麦醇溶蛋白/阿拉伯胶纳米颗粒负载百里香酚,可改善百里香酚的稳定性。孔祥珍等[15]研究表明麦醇溶蛋白自组装纳米粒有效地提高了白藜芦醇的稳定性。目前尚未有采用麦醇溶蛋白纳米粒子运载PT的相关研究报道。
本研究利用反溶剂法制备麦醇溶蛋白负载PT的纳米粒子(phlorotannins-loaded gliadin nanoparticles,GPNPs),旨在提高PT的稳定性,通过考察麦醇溶蛋白与PT不同质量比对GPNPs纳米粒子粒径,ζ电位、包埋率、负载率的影响,并借助傅立叶变换红外吸收光谱(Fourier transform infrared spectroscopy,FTIR)、X射线衍射(X-ray diffraction,XRD)、透射电子显微镜(transmission electron microscope,TEM)等方法研究GPNPs纳米粒子的微观结构及特性,并进一步探讨麦醇溶蛋白与PT形成纳米粒子机理,以期为提高PT的稳定性和生物利用度提供相关依据。
1 材料与方法
1.1 材料与仪器
褐藻多酚,西安百川生物科技有限公司;麦醇溶蛋白(食品级),源叶生物;胃蛋白酶、胰蛋白酶、无水乙醇(化学纯),国药集团化学试剂有限公司。
UV-2600 紫外可见分光光度计,日本岛津公司;NanoPlus 3 Zeta电位与纳米粒度仪,美国麦克仪器公司;AVATAR360 型傅里叶红外光谱,美国尼高力仪器公司;X’pert3 and Empyrean X-射线粉末衍射仪,Netherlands Panalytical;Tecnai G2 F20/F30场发射透射电子显微镜,美国FEI公司;DF101-S 磁力加热搅拌器,杭州仪表电机有限公司;HT-110X 系列水浴振荡器,金坛区金城春兰实验仪器厂;RE-5299旋转蒸发仪,上海圣科仪器设备有限公司。
1.2 实验方法
1.2.1 GPNPs的制备
称取粉末状麦醇溶蛋白4.00 g,加入到100 mL 70%(体积分数)乙醇溶液中溶解,在磁力搅拌器中以500 r/min搅拌2 h,制得质量浓度400 mg/mL 麦醇溶蛋白溶液。分别取0、10、20、30、40 mL质量浓度40 mg/mL的PT溶液与麦醇溶蛋白溶液混合,取上述溶液10 mL以8 mL/h的速度滴入到100 mL水中。用旋转蒸发器去除所有乙醇和部分水。最终将溶液储存在4 ℃下备用,将不同的PT加入量样品记为GPNPs0、GPNPs1、GPNPs2、GPNPs3、GPNPs4。
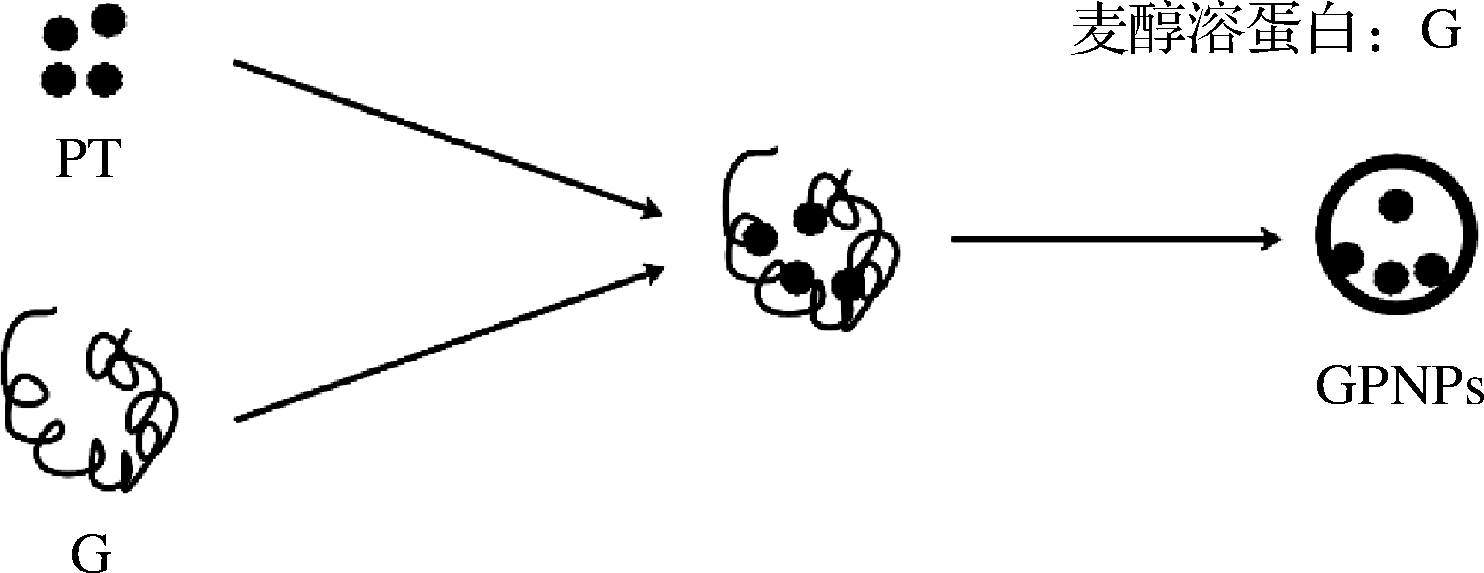
图1 GPNPs制备示意图
Fig.1 Schematic diagram of the preparation of GPNPs
1.2.2 粒径和ζ电位分析
用ζ电位与粒度仪测定新鲜悬浮液的粒径和ζ电位。将悬浮液稀释10倍,然后调整pH进行分析。每个试验采用3次独立悬液重复测定,每次测定3次。
1.2.3 PT标准曲线的制作
按照参考文献[16]的方法制备PT标准曲线及计算总酚含量,得到PT浓度与吸光值的标准曲线方程为y=0.121 6x+0.054 9(R2=0.999 4),根据此方程计算PT浓度。测定的总酚含量为137 mg/g。
1.2.4 包埋率和承载率分析
取5 mL纳米粒悬浮液于10 mL离心管中,4 000×g离心30 min,取上清液1 mL于10 mL容量瓶,加水稀释,混匀,加入1.25 mL Folin-Ciocalteu试剂,3 min后加入4 mL质量分数为10%的Na2CO3溶液,定容至10 mL,混匀,30 ℃避光反应60 min,在760 nm波长处测定样品溶液的吸光度,根据褐藻多酚标准曲线得到溶液中游离的褐藻多酚的质量,空白纳米粒溶液作为对照[17]。包封率(encapsulation efficiency,EE)和承载量(loading capacity,LC)分别按公式(1)、公式(2)计算:
![]()
(1)
![]()
(2)
式中:m总,褐藻多酚的总投入质量,g;m游,游离的褐藻多酚质量,g;m微粒,干燥微粒的质量,g。
1.2.5 TEM分析
取一滴溶液于铜网上,自然晾干后,用质量分数为2%磷钨酸溶液进行染色,负染30 min后,用滤纸吸走多余染液。将铜网置于TEM下观察并拍照。加速电压为80 kV。
1.2.6 FTIR分析
将制备得到的复合物冻干,按质量比1∶100的比例与KBr混匀并在玛瑙研钵中研碎,压片,用傅立叶红外光谱仪在波长范围内扫描测定。光谱测定范围4 000~400 cm-1,仪器分辨率为0.5 cm-1,扫描次数32次。
1.2.7 XRD分析
将制备得到的复合物冻干,采用X射线粉末衍射仪分别对PT、GNPS及GPNPs复合物进行光谱扫描分析,扫描角度范围5~70°,扫描速度为2°/min。
1.2.8 模拟体外消化分析
1.2.8.1 人工胃液(simulated gastric fluid,SGF)的配制
用电子分析天平精确称量NaCl 2.0 g,将其倒入去离子水中搅拌溶解。再用量筒量取体积分数37%的HCl溶液7.0 mL 缓慢倒入NaCl溶液中。随后将上述溶液转移到1 L容量瓶中,用去离子水定容。使用pH计对其进行检测并进行相应校正,最终获得pH为1.2的模拟胃液。在GPNPs开始进行模拟反应前1 h将胃蛋白酶Pepsin(3.2 g/L,3 000 NFU/g)溶解于模拟胃液中。
1.2.8.2 人工肠液(simulated intestinal fluid,SIF)的配制
用电子分析天平精确称量NaOH 4.0 g,将其倒入去离子水中搅拌溶解,再转移到500 mL的容量瓶中,定容备用。用电子分析天平精确称量磷酸二氢钾6.8 g,将其倒入250 mL去离子水中搅拌溶解。再用量筒量取上述配制好的0.2 mol/L NaOH标准液190 mL缓慢倒入磷酸二氢钾溶液中。随后将上述溶液转移到1 L容量瓶中,用去离子水定容。使用pH计对其进行检测并进行相应校正,最终获得 pH为7.4的模拟肠液。在GPNPs开始进行模拟反应前1 h将胰蛋白酶 Trypsin(3.2 g/L,250 NFU/mg)溶解于模拟肠液中。
取2 mL纳米粒子溶液于15 mL离心管中,并加入8 mL模拟液(或肠液),将得到的混合液放在37 ℃的恒温摇床中以100 r/min振荡,在不同时间取出离心管,以8 000 r/min离心5 min,取1.0 mL,加水稀释,加入1.25 mL Folin-Ciocalteu试剂,混匀,3 min后加入4.0 mL质量浓度0.1 g/mL NaCO3溶液,加水定容至10 mL,混匀,30 ℃避光反应60 min,在760 nm处测定吸光度。根据标准曲线和稀释倍数计算PT的含量[18]。
1.2.9 DPPH清除率分析
准确称取50 mg纳米粒子粉末样品,加入5 mL纯水并搅拌1 h。配制质量浓度40 mg/L的DPPH乙醇溶液,避光搅拌。将1 mL样品溶液或纯水与2 mL DPPH溶液混合并振荡,常温避光储存30 min。将此混合液在517 nm处通过测定吸光值检测残留的DPPH自由基[9]。纳米粒子的DPPH自由基清除率通过公式(3)计算:
DPPH自由基清除率![]()
(3)
式中:A样,样品混合DPPH溶液后的吸光值;A水,纯水混合DPPH溶液后的吸光值;最终结果取3次测量的平均值。
1.3 数据分析
所有试验均进行3次平行试验,数据分析采用SPSS 17.0和Excel 2016软件进行处理。
2 结果与分析
2.1 GPNPs的粒径和ζ电位
GPNPs的粒径和ζ电位如表1所示,GPNPs0的粒径为(166.20±5.03)nm,与文献所报道的一致[19]。随着PT含量的增大,GPNPs1、GPNPs2、GPNPs3粒径与GPNPs0的粒径大小基本一致,约为170 nm,但分散指数值不稳定,分别为(0.41±0.03)、(0.46±0.01)、(0.34±0.01)(P<0.5),GPNPs4的粒径增大至(346.70±5.13)nm。GPNPs0的Zeta电位为(15.95±0.04)mV,随着PT加入,其Zeta电位有所下降,GPNPs1、GPNPs2、GPNPs3的ζ电位基本一致,约为14.00 mV,但GPNPs4的ζ电位为(12.83±0.28)mV,可能由于PT的含量过高,部分PT未被包埋在粒子内,而是附着在粒子表面和游离在体系中,导致其粒径增大和体系稳定性下降[20]。
表1 不同麦醇溶蛋白与褐藻多酚比例对纳米粒子的粒径、多分散性系数、ζ电位的影响
Table 1 Influence of ratios of G to PT on the particle size, polydispersity coefficient, and ζ potential of nanoparticles
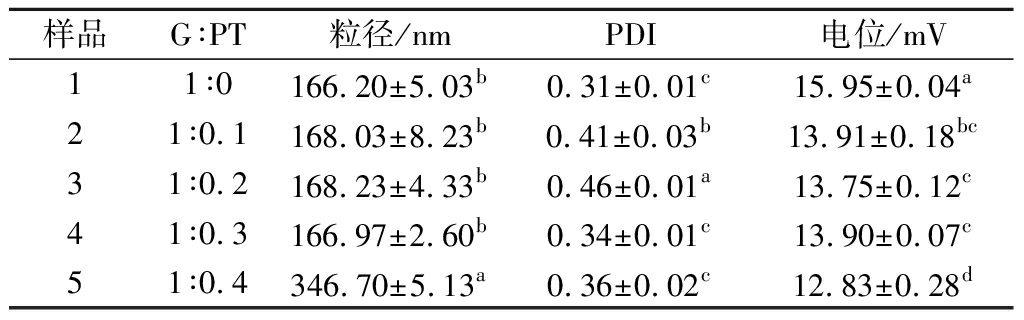
注:不同字母表示不同样品具有差异显著性(P<0.05);表中G表示麦醇溶蛋白(下同)
2.2 GPNPs的包埋率和承载率
GPNPs的包埋率和承载率如图2所示,GPNPs1的包埋率为55.4%,随着PT含量的增大,其包埋率也在增大,但GPNPs3的包埋率最大,为71.7%,GPNPs4包埋率有所下降,为66.4%。可能由于GPNPs3包埋率达到最大,继续添加过量的PT,麦醇溶蛋白无法包埋,这与樊永康等[21]的研究结果一致。粒子的粒径和ζ电位在GPNPs4也发生了变化,与粒子包埋情况相吻合。复合物的承载率随着PT含量的增大而增大,从8.6 %升至34.8%。
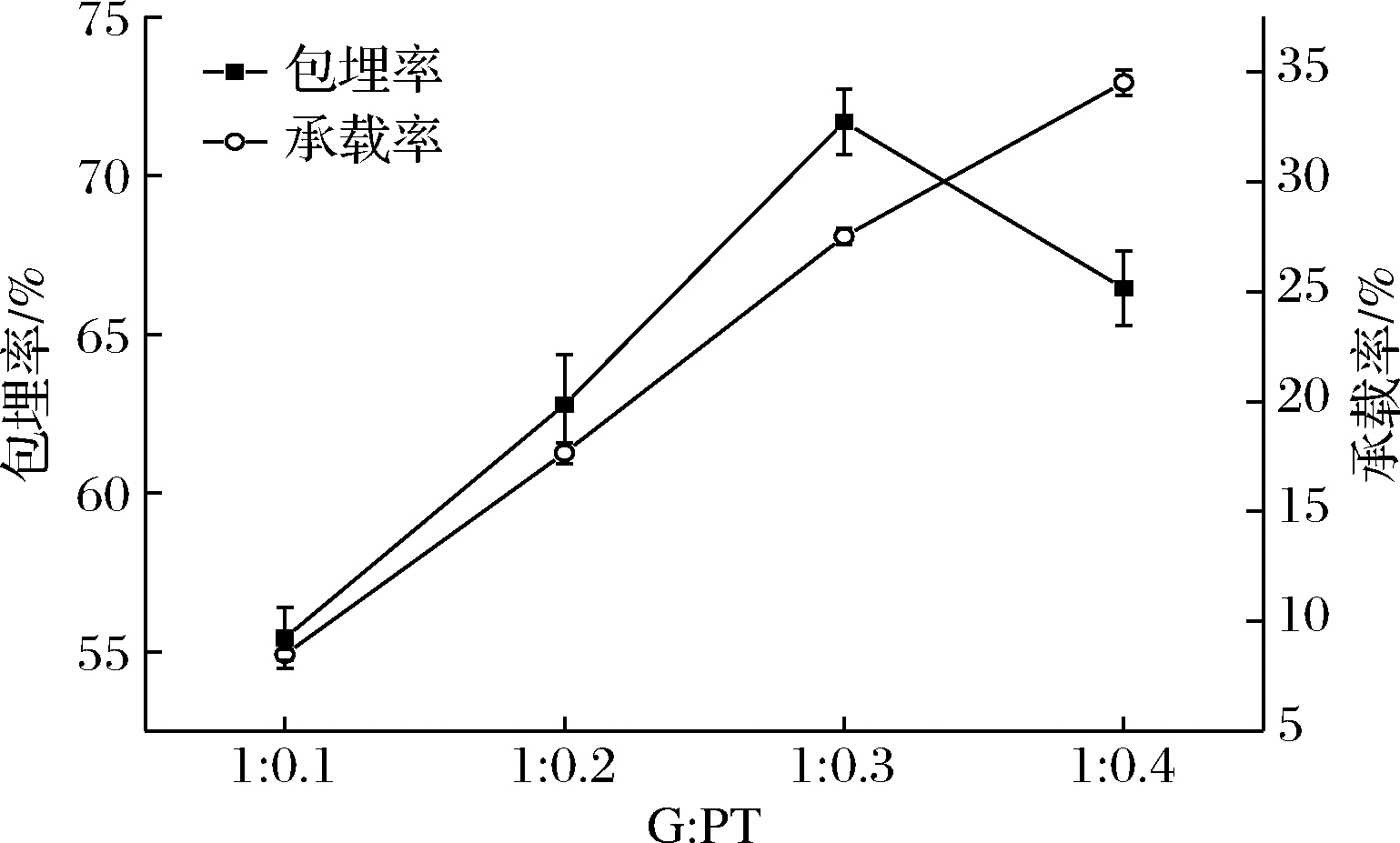
图2 PT的包埋率及承载率
Fig.2 Embedding rate and carrying rate of PT
2.3 GPNPs的TEM
GPNPs的TEM如图3所示,其纳米粒子呈类球形或圆球形,大小均一,分布均匀。可能由于透射电子显微镜是将样品干燥后进行检测的,而马尔文粒径仪是检测纳米粒子水合状态下的尺寸,所以透射电子显微镜检测到的粒子与马尔文粒径仪检测的粒子尺寸相比更小[22]。

图3 GPNPS的TEM图像
Fig.3 TEM images of GPNPS
2.4 GPNPs的FTIR
使用FTIR在波长4 000~400 cm-1内测量样品的红外吸收光谱,包括单纯物质及复合物的红外光谱如图4所示。在PT谱图中,3 387 cm-1处为O—H的伸缩振动;2 928 cm-1处为C—H伸缩振动;1 625 cm-1处为C![]() O伸缩振动;1 446 cm-1处为芳环骨架C
O伸缩振动;1 446 cm-1处为芳环骨架C![]() C的伸缩振动吸收带;857、776、699、569 cm-1处为芳环
C的伸缩振动吸收带;857、776、699、569 cm-1处为芳环![]() C—H面外弯曲振动峰[23]。在麦醇溶蛋白的谱图中,3 280 cm-1处为酰胺Ⅲ带,氢键和N—H伸缩振动;2 937 cm-1处为脂肪族C—H伸缩振动;1 640 cm-1处为酰胺I带,C
C—H面外弯曲振动峰[23]。在麦醇溶蛋白的谱图中,3 280 cm-1处为酰胺Ⅲ带,氢键和N—H伸缩振动;2 937 cm-1处为脂肪族C—H伸缩振动;1 640 cm-1处为酰胺I带,C![]() O伸缩振动;1 528 cm-1处为酞胺II带,C—N伸缩振动与N—H弯曲振动;1 446 cm-1处为CH3、CH2、CH的弯曲振动;1 230 cm-1处为色氨酸或脂肪族C—H弯曲振动[24]。在GPNPs图中,氢键和N—H伸缩振动由3 280移至3 275 cm-1,C—H伸缩振动由2 937移至2 932 cm-1,C—N伸缩振动与N—H弯曲振动由1 528移至1 536 cm-1,这表明PT,可能通过氢键、疏水作用等作用力与麦醇溶蛋白发生相互作用。但在GPNPs谱图中无苯环骨架等特征吸收峰,这表明麦醇溶蛋白已经成功包裹了PT[21]。
O伸缩振动;1 528 cm-1处为酞胺II带,C—N伸缩振动与N—H弯曲振动;1 446 cm-1处为CH3、CH2、CH的弯曲振动;1 230 cm-1处为色氨酸或脂肪族C—H弯曲振动[24]。在GPNPs图中,氢键和N—H伸缩振动由3 280移至3 275 cm-1,C—H伸缩振动由2 937移至2 932 cm-1,C—N伸缩振动与N—H弯曲振动由1 528移至1 536 cm-1,这表明PT,可能通过氢键、疏水作用等作用力与麦醇溶蛋白发生相互作用。但在GPNPs谱图中无苯环骨架等特征吸收峰,这表明麦醇溶蛋白已经成功包裹了PT[21]。
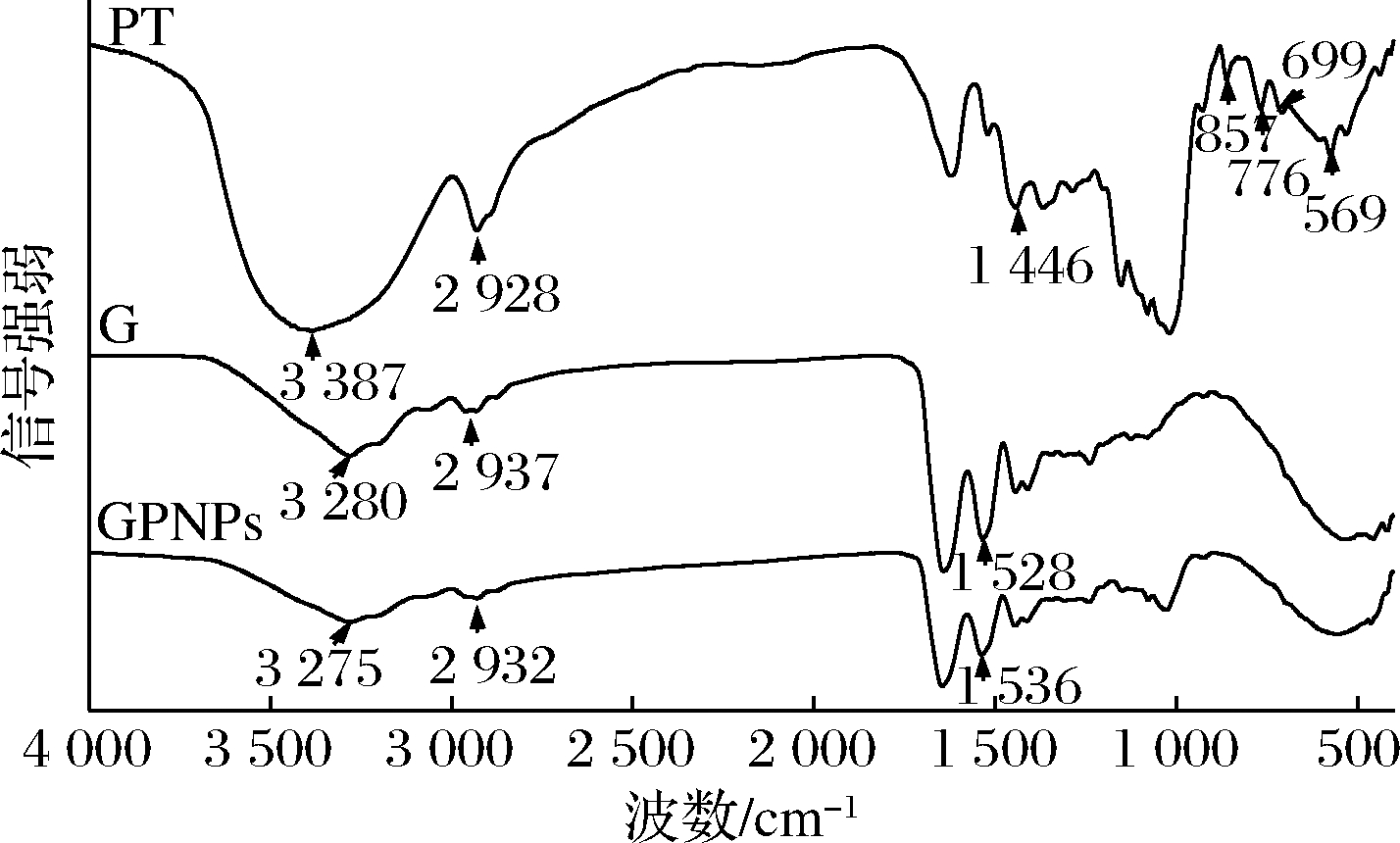
图4 麦醇溶蛋白、PT、GPNPS的FTIR图
Fig.4 FTIR spectra of gliadin,PT,GPNPs
2.5 GPNPs的XRD
图5比较了纯的PT、麦醇溶蛋白和GPNPs复合物的XRD谱图。PT的主要衍射峰位于16.1、18.5和23.4,表明PT有结晶度,而麦醇溶蛋白的XRD谱图中,未出现明显的峰,表明麦醇溶蛋白的结晶度较低。PT的晶体射峰未在GPNPs复合物中出现,这表明PT被包埋在麦醇溶蛋白纳米粒子内,以无定型态的方式分布在纳米粒子中[25]。
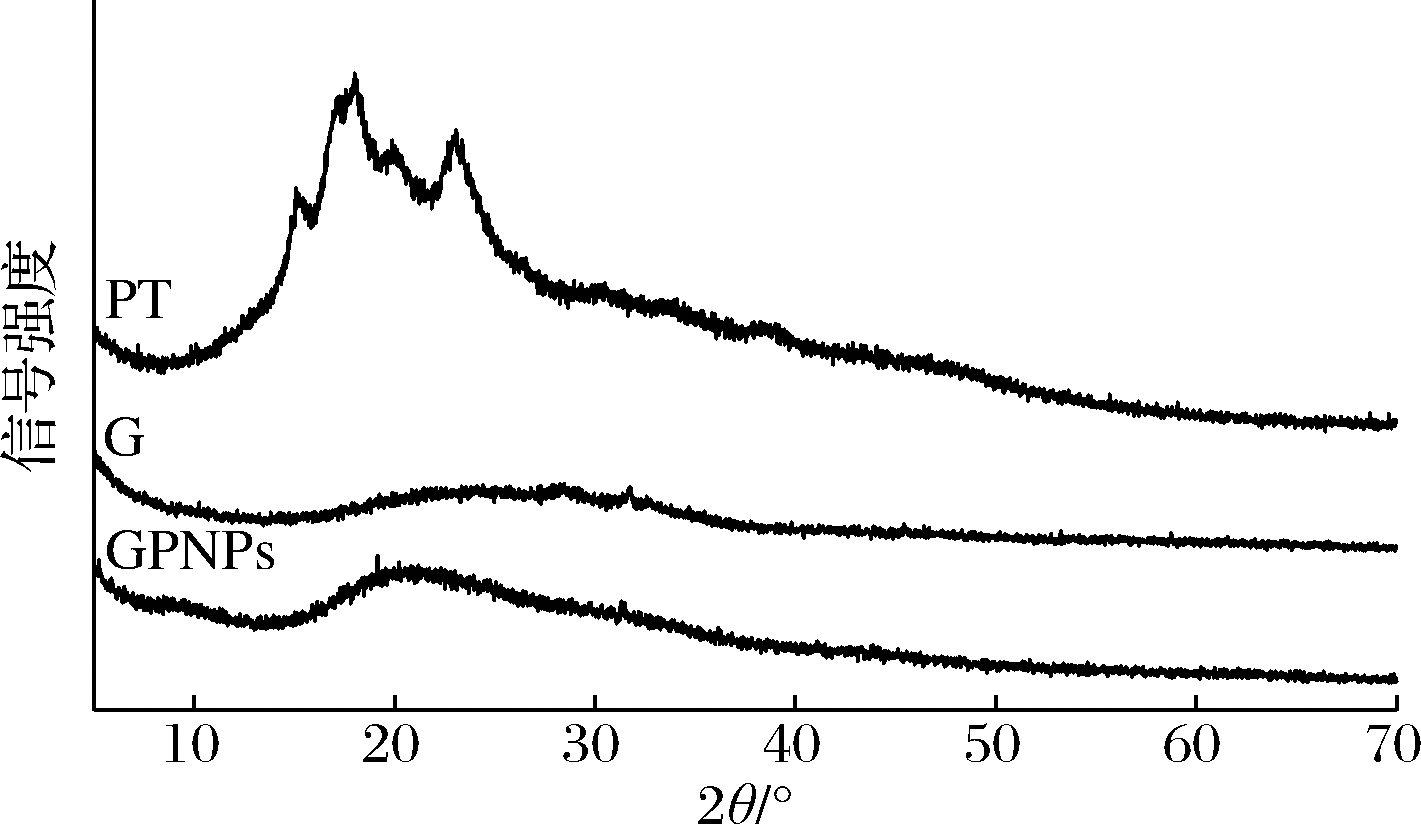
图5 麦醇溶蛋白、PT、GPNPS的XRD图
Fig.5 XRD spectra of gliadin、PT、GPNPs
2.6 GPNPs的模拟体外消化
GPNPs在SGF、SIF中的累积释放效果如图6,在SGF中,GPNPs4在120 min累计释放率达到55%,而GPNPs1、GPNPs2、GPNPs3累计释放率约为40%。这可能与图2粒子的包埋率有关。
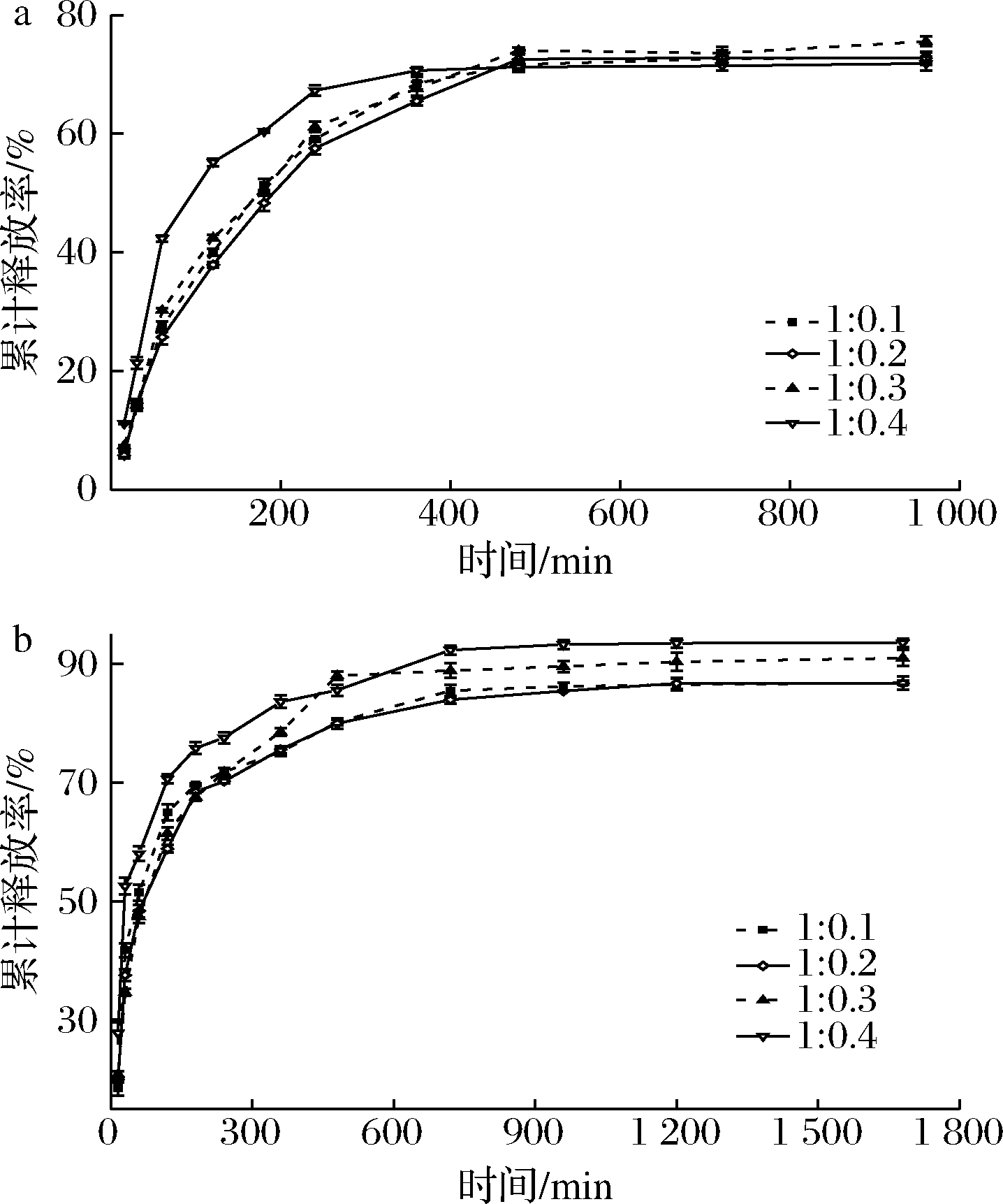
a-GPNPs在SGF中的累计释放率;b-GPNPs在SIF中的累计释放率
图6 GPNPs的体外消化模拟图
Fig.6 In vitro digestion simulation of GPNPs
由图6可知,随着时间的延长,复合粒子的累计释放速率有所减缓,且GPNPs4与其他组的差距缩小。在480 min后,累计释放率无显著性差异,且复合粒子达到稳定释放的状态,GPNPs3累计释放率约为75%,略高于其他3组。在SIF中,GPNPs在30 min内表现出突释行为,GPNPs1、GPNPs4累计释放率分别达到41%、52%。在30 min后,GPNPs的释放速率有所减缓,各组之间的差距也在不断缩小。在720 min后,GPNPs达到稳定释放的状态,GPNPs4累计释放率最高,约为93%,GPNPs1和GPNPs2累计释放率无明显差异,约为87%。随着时间的增长,其PT累计释放率处于一个稳定的水平,这与PT在溶剂中的溶解度、麦醇溶蛋白的稳定性、PT与麦醇溶蛋白之间的相互作用力及麦醇溶蛋白对PT的包埋程度等多种因素有关[26]。在SGF、SIF中,一开始的突释行为可能是GPNPs中存在未完全包埋的PT及负载在粒子表面的PT,这2种PT的存在方式作用力较弱,容易释放到溶剂中。
2.7 GPNPs的DPPH自由基清除率
PT对环境的敏感性非常高,PT抗氧化性容易受到影响。GPNPs复合物的自由基清除率如图7所示,在没有加入PT时,单纯的GNPs的自由基清除率为3.34%,说明麦醇溶蛋白也有一定的抗氧化能力。随着PT量的增大,自由基清除率也不断的升高,GPNPs4自由基清除率达到了47.06%,表明包埋后的PT仍具有一定抗氧化活性[27]。
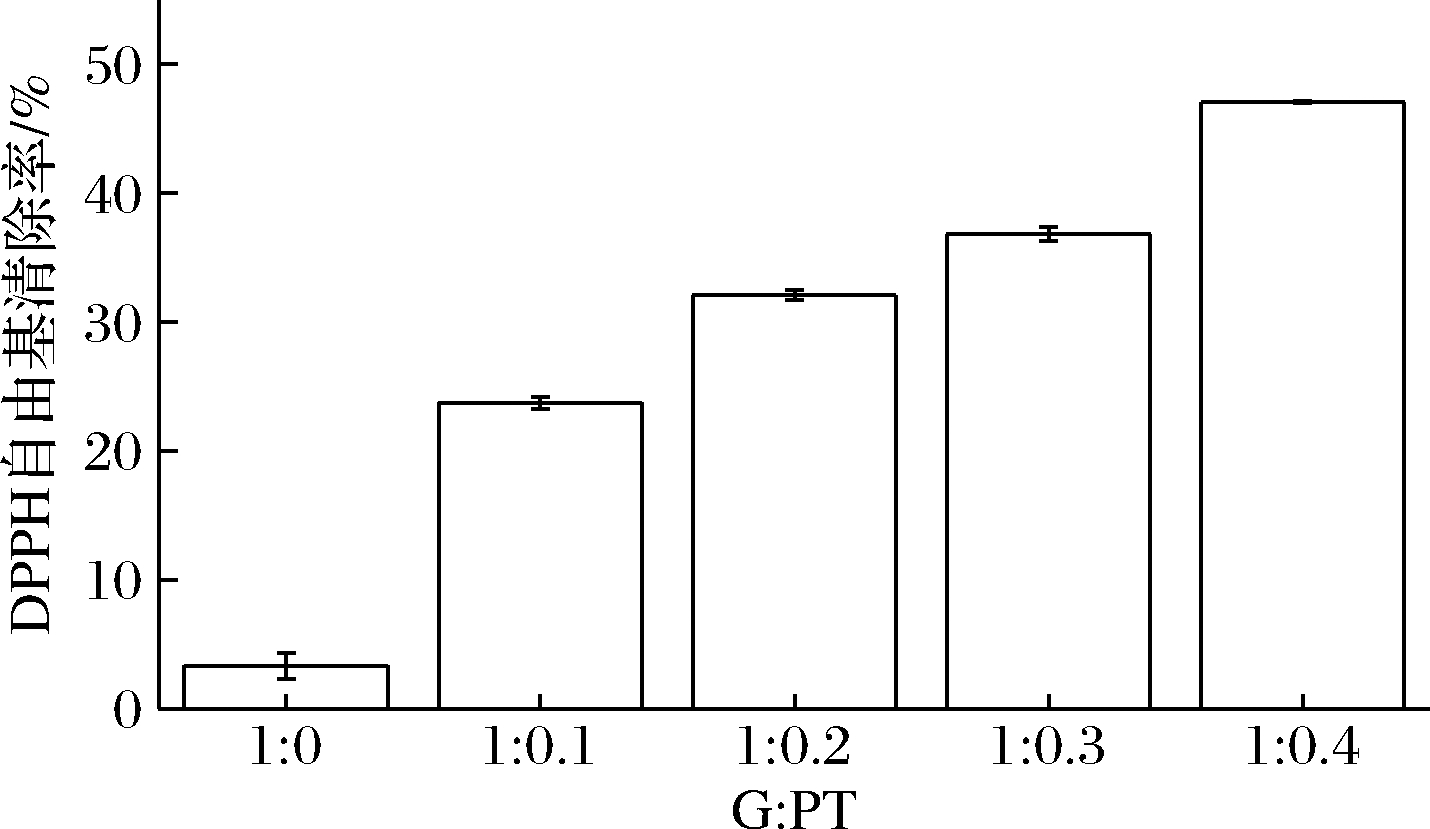
图7 GPNPs的DPPH自由基清除率
Fig.7 DPPH free radical scanvenging rate of GPNPs
3 结论
利用麦醇溶蛋白包埋PT,提高了PT的稳定性。通过纳米粒度仪研究GPNPs的纳米直径分布、ζ电位,确定麦醇溶蛋白与PT的最优结合体积比为1∶0.3,形成粒径为166 nm的纳米粒子。TEM和XRD研究结果表明PT被麦醇溶蛋白包埋在粒子中。FTIR结果表明麦醇溶蛋白与PT结合后,两者之间发生了相互作用力。体外模拟消化研究表明,GPNPs有缓慢释放的效果,减慢了释放速率,提高了PT在人体内的消化利用率。研究表明,麦醇溶蛋白可以降低PT在食品加工、运输和消化吸收中降解和损失率,是一种极具潜力的纳米递送系统。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



