重组限制性内切酶Pst I发酵条件优化
限制性内切酶(简称为“限制酶”)是一大类能够特异性识别与切割 DNA 分子内特定序列的核酸内切酶,被称作“基因的剪刀”、“分子手术刀”等[1-4],被广泛应用于DNA重组、基因定位与克隆、核酸疫苗制备等生物医药的各个领域[5-7]。
限制性内切酶来源于原核生物的“限制-修饰”系统,原始宿主自身的DNA被自身限制酶对应的甲基化酶修饰,从而避免被自身所产生的限制酶切割[8]。但常用的蛋白质工程菌宿主DNA不具备相应的甲基化修饰,直接重组表达限制酶会导致宿主因DNA被切割而死亡。因此,限制酶的大规模生产一直是世界性的难题,自20世纪70年代第一个限制性内切酶产品上市以来的40多年里,全球限制性内切酶市场几乎一直被美国NEB、美国Thermo Fisher、日本TaKaRa等几家企业垄断。
本实验室在前期研究中,利用广谱甲基化保护策略,实现了多种限制性内切酶的重组表达[8-9],成果初步实现产业化,性能不亚于国外同类产品。但企业现有生产工艺仍停留在低密度摇瓶培养的阶段,产量低,成本高,无法满足行业需求。而将摇瓶发酵工艺参数直接移植到发酵罐之后,几乎所有的限制酶均出现了产率下降的现象,少数种类甚至无法成功表达。因此,开发限制酶的高密度发酵工艺,是实现限制性内切酶国产化的必经之路。
限制性内切酶Pst I是1976年从斯氏普罗威登斯菌(Providencia stuartii)中分离出来的一种II型限制性内切酶,是最常用的30种限制酶之一[10]。本研究以Pst I为代表,使用大肠杆菌作为重组表达宿主,对影响菌体量与酶产率的发酵条件进行了筛选,优化了Pst I的重组表达发酵条件,同时也为实现其他限制性内切酶的大规模生产提供了参考。
1 材料与方法
1.1 材料与试剂
Pst I大肠杆菌重组表达菌株,本实验室自行制备保存;商品lightingTMPst I酶、CutOneTM反应缓冲液、无缝克隆试剂盒,江苏愚公生命科技有限公司;Ni 亲和层析基质(Toyopearl AF),东曹(上海)生物科技有限公司;HiTrap Heparin亲和层析柱,美国GE公司;Lambda DNA与B-PER细胞裂解液,美国Thermo Fisher Scientific公司;其他未注明试剂均为分析纯,中国国药控股有限公司。
1.2 仪器与设备
恒温金属浴,杭州米欧仪器有限公司;恒温震荡摇床,上海一恒科技有限公司;GenoSens1860凝胶成像系统,上海勤翔科学仪器有限公司;JN-02细胞高压破碎仪,广州聚能生物科技有限公司;Avanti J-26 s XP 高速冷冻离心机,美国Beckman公司;高速冷冻离心机,德国Eppendorf公司;Synteny Neo2多功能酶标仪,美国Bio Tek公司;T100梯度PCR仪,美国Bio-Rad公司;六联排玻璃发酵罐(1 L×6),上海百仑生物科技有限公司;NanoDrop Lite 分光光度计,美国Thermo Scientific公司。
1.3 Pst I 发酵条件优化
1.3.1 优化发酵温度
取本实验室保藏的Pst I大肠杆菌重组表达菌株在含有0.1 g/L卡那霉素和0.15 g/L氯霉素的LB平板培养基上划线,37 ℃培养活化。挑取阳性单克隆,测序验证后接种于10 ml LB液体培养基中,37 ℃,200 r/min过夜培养,获得发酵种子液。然后以5%(体积分数,下同)的接种量接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中,于六联排玻璃发酵罐中400 r/min进行发酵。当发酵液OD600到达0.8时,使用终浓度0.5 mmol/L 的IPTG进行诱导,分别设置发酵温度为37、30、23与16 ℃,发酵12 h。
1.3.2 优化诱导后发酵时间
将种子液以5%的接种量接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中,于六联排玻璃发酵罐中发酵。当发酵液OD600到达0.8时,使用终浓度0.5 mmol/L 的IPTG进行诱导,同时分别设置诱导后发酵时间为2、4、6、8、10、12、14、16与18 h。
1.3.3 优化诱导剂浓度
将种子液以5%的接种量接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中,于六联排玻璃发酵罐中发酵。当发酵液OD600到达0.8时,使用终浓度分别为0.4、0.6、0.8、1.0、1.2、1.4、1.6、1.8与2.0 mmol/L的IPTG进行诱导。
1.3.4 优化补充碳源
将种子液以5%的接种量接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中,同时分别添加10 g/L的葡萄糖、甘油、蔗糖与麦芽糖作为补充碳源,于六联排玻璃发酵罐中发酵。当发酵液OD600到达0.8时,使用IPTG进行诱导。
1.3.5 优化pH值
将种子液以5%的接种量分别接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中,于六联排玻璃发酵罐进行发酵。在发酵开始前使用10%氨水 与10%磷酸(均为体积分数,下同)分别调整发酵体系pH值为5.0、6.0、7.0、8.0与9.0(±0.2)。当发酵液OD600到达0.8时,使用IPTG进行诱导。
1.3.6 优化诱导时机
将种子液以5%的接种量分别接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中于六联排玻璃发酵罐进行发酵。然后于每2 h测定发酵液OD600,绘制菌体生长曲线。
将种子液以5%的接种量分别接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中于六联排玻璃发酵罐进行发酵。在发酵开始时使用10%氨水与10%磷酸调整发酵体系pH值,当发酵进行到2、4、6与8 h时使用IPTG进行诱导。
1.4 Pst I 酶活力检测
本研究中Pst I酶活力采用如下定义:37 ℃下,在10 μl反应体系中,能够在15 min内完全消化1 μg Lambda DNA所需的酶量定义为1 U。发酵结束后取1 ml发酵液5 500 r/min,5 min离心分离菌体与上清液。将菌体控干水分置于-20 ℃下,加入100 μl B-PER细胞裂解液裂解菌体4 ℃,13 000×g,20 min离心获得粗酶液。取20 μl粗酶液,以2倍梯度稀释。酶活力测试反应体系为10 μl,包括1 μl稀释酶液,1 μg Lambda DNA以及1 μl 10× CutOne缓冲液,将其置于恒温金属浴中37 ℃ 孵育15 min,然后将其移至已预热至80 ℃的恒温金属浴中失活20 min,使用琼脂糖凝胶电泳检测酶切产物。第1个无法完全消化Lambda DNA底物的稀释梯度所对应的上一级稀释液酶浓度即为1 U/μl。
1.5 Pst I 蛋白纯化
将种子液以5%的接种量分别接种于含有0.1 g/L卡那霉素与0.15 g/L氯霉素的2YT液体培养基中于发酵罐进行发酵。在发酵开始时使用10%氨水与10%磷酸调整发酵体系pH值,使用IPTG进行诱导,待发酵结束后,破碎细胞并依次使用Ni亲和层析柱与肝素亲和层析柱对Pst I蛋白进行纯化,使用SDS-PAGE检测纯化后蛋白,同时使用NanoDrop Lite 分光光度计对蛋白浓度进行测定。
2 结果与分析
2.1 发酵条件优化
2.1.1 优化发酵温度
温度是影响菌体生长代谢、重组产物形成与质粒稳定性的重要因素。大肠杆菌最适生长温度为37 ℃,最高生长温度为41.6 ℃,最低生长温度为8.46 ℃[11],因此为获得高水平Pst I蛋白表达,需对发酵温度进行优化。随着诱导温度增加,酶产率呈不断增加趋势;当发酵温度为37 ℃时,酶产率菌体量最高(图1)。可能是因为37 ℃ 时菌体生长速度、蛋白的表达速度与相关酶活性高,有利于Pst I蛋白积累。
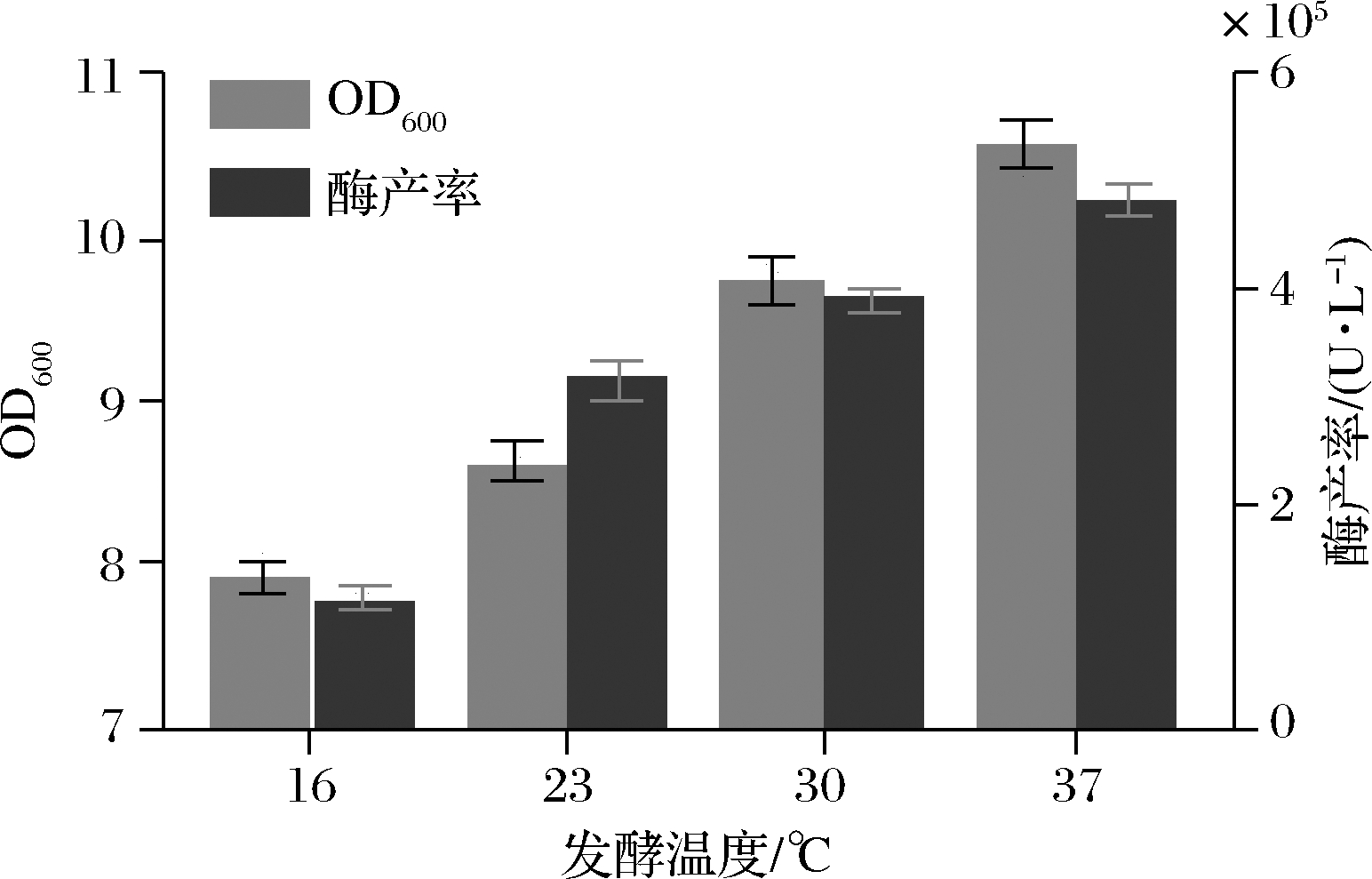
图1 发酵温度对菌体生长及酶产率的影响
Fig.1 Effect of culture temperatures on the growth of engineering bacteria and Pst I production
2.1.2 优化诱导后发酵时间
诱导后发酵时间是影响外源基因重组表达的重要因素[12],尤其对于限制性内切酶而言,发酵时间过短则蛋白表达量不够,发酵时间过长则有可能积累细胞毒性导致宿主细胞死亡。如图2所示,随诱导后发酵时间的增加,Pst I酶产率表现出先增加后降低的趋势,同时菌体量随发酵时间的增加而不断增加,因此Pst I菌株最佳诱导后发酵时间为8 h时。

图2 诱导后发酵时间对菌体生长及酶产率的影响
Fig.2 Effect of post-induction fermentation times on the growth of engineering bacteria and Pst I production
2.1.3 优化IPTG诱导浓度
本研究所使用的重组表达载体是在pET28b基础上构建的,具有乳糖操纵子调控的启动子,可使用乳糖类似物IPTG(异丙基-β-D-硫代半乳糖苷)进行诱导表达[13]。但IPTG具有潜在毒性,过量添加对菌体生长具有一定的抑制作用[14]。随着IPTG浓度增加,Pst I酶产率呈现先增加后减少的趋势(图3-a),同时菌体量随IPTG诱导浓度的增加而呈现不断降低(图3-b),因此Pst I菌株最佳IPTG诱导浓度为1.4 mmol/L。
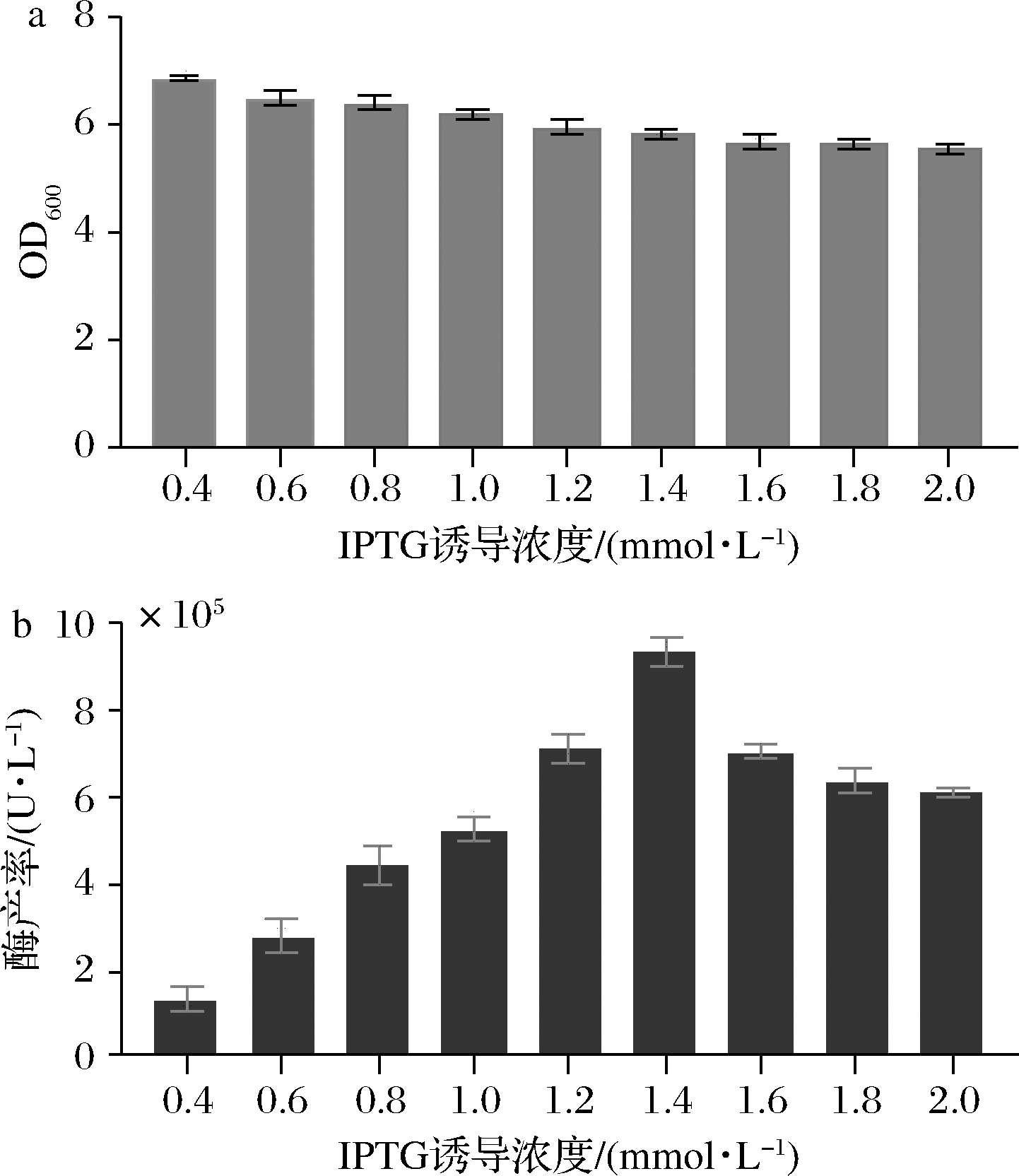
a-菌体浓度;b-酶产率
图3 IPTG诱导剂浓度对菌体生长及酶产率的影响
Fig.3 Effect of IPTG concentrations on the growth of engineering bacteria and Pst I production
2.1.4 优化补充碳源
在高密度发酵中,通常需要添加额外碳源,以满足大肠杆菌高密度发酵的要求[15]。大肠杆菌高密度发酵中常用碳源有葡萄糖、甘油、蔗糖与麦芽糖[16]。由图4可知在甘油、葡萄糖、麦芽糖与蔗糖中,使用甘油作为额外碳源酶Pst I酶产率与菌体量最高,考虑到使用甘油作为补充碳源,可以减少发酵过程中乙酸积累,有利于菌体的生长。因此Pst I菌株最适补充碳源为甘油。
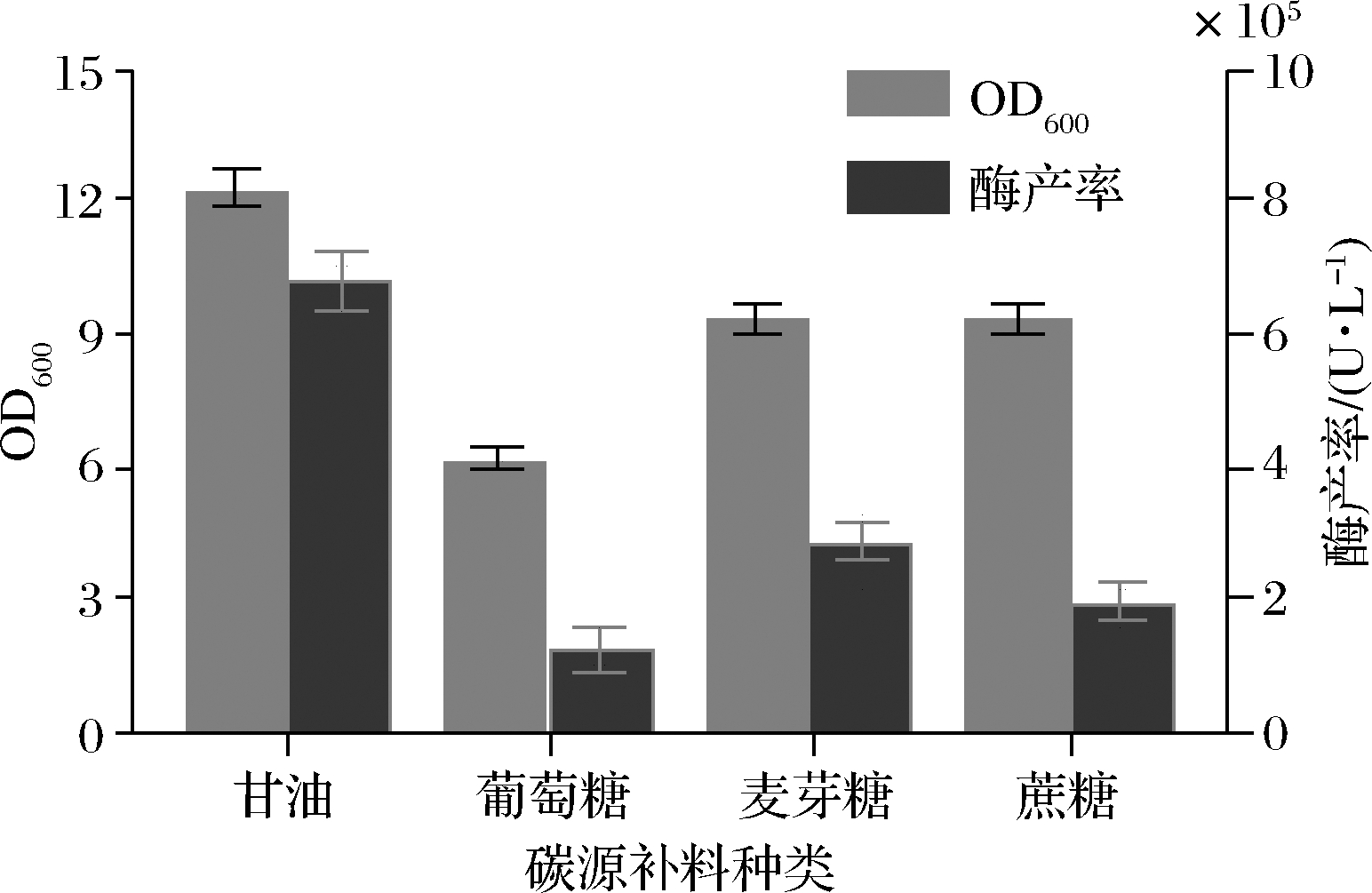
图4 碳源对菌体生长及酶产率的影响
Fig.4 Effect of carbon sources on the growth of engineering bacteria and Pst I production
2.1.5 优化pH值
pH作为影响发酵的关键因素之一,其对高密度发酵中的菌体量与酶产率具有较大影响[17-18]。大肠杆菌生长pH范围为5.35~9.72,最适宜pH为7.79[19]。由图5可知,菌体量在pH 5.0~9.0呈现先增加后降低的趋势,pH 5.0~8.0菌体量持续增加,pH在8.0~9.0,菌体量开始降低。Pst I酶产率随pH的改变也呈现先增加后降低的趋势,在pH 8.0时为最高酶产率。使用Expasy在线工具对Pst I蛋白的等电点进行计算[20],可知Pst I蛋白的等电点为8.34。同时由大肠杆菌的最适pH为7.79和本次实验结果,推测Pst I菌株最适发酵pH为8.0。
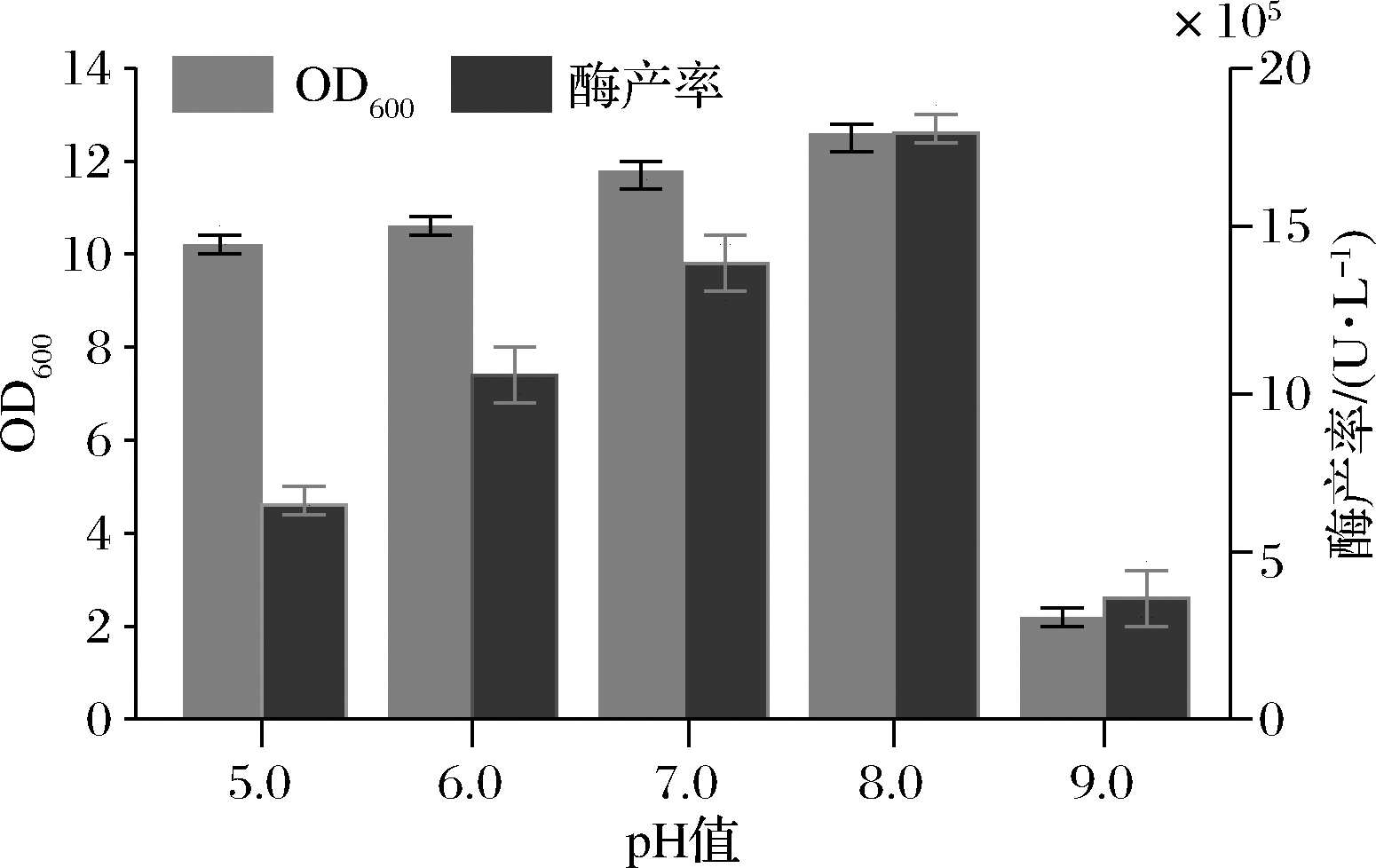
图5 pH值对菌体生长及酶产率的影响
Fig.5 Effect of pH on the growth of engineering bacteria and Pst I production
2.1.6 优化诱导时机
对Pst I重组表达菌株进行生长曲线测定可以确定菌株生长情况,从而为优化诱导时机提供依据。由Pst I菌体生长曲线可知(图6-a),0~3 h为菌体生长延滞期,3~15 h为菌体生长对数期,15 h之后进入平台期。添加诱导剂的时间一般为为菌体的对数生长期的前期或者中期[21]。为了筛选得到合适的诱导时机,根据菌体生长曲线与课题组已有相关实验,在发酵进行到2、4、6与8 h时分别添加终浓度1.4 mmol/L的IPTG,进行最佳诱导时机筛选实验。
结果表明(图6-b),菌体量在诱导时机2~8 h内呈现波动趋势,同时Pst I酶产率也随诱导时机的不断增加而呈现先增加后降低的趋势。诱导时机为6 h时获得最高菌体量与酶产率,同时由生长曲线可知6 h位于菌体生长的对数生长中期,菌体生长旺盛,更适合目标蛋白的积累。因此Pst I菌株最适诱导时机为6 h。本研究采用GpC广谱甲基化修饰保护的策略来重组表达限制酶,会引起基因组的大范围过度甲基化,而甲基化会抑制大多数基因转录,从而导致细胞生长受到影响。因此在Pst I等限制酶重组表达过程中,发酵菌液的OD600明显低于普通大肠杆菌发酵[22]。
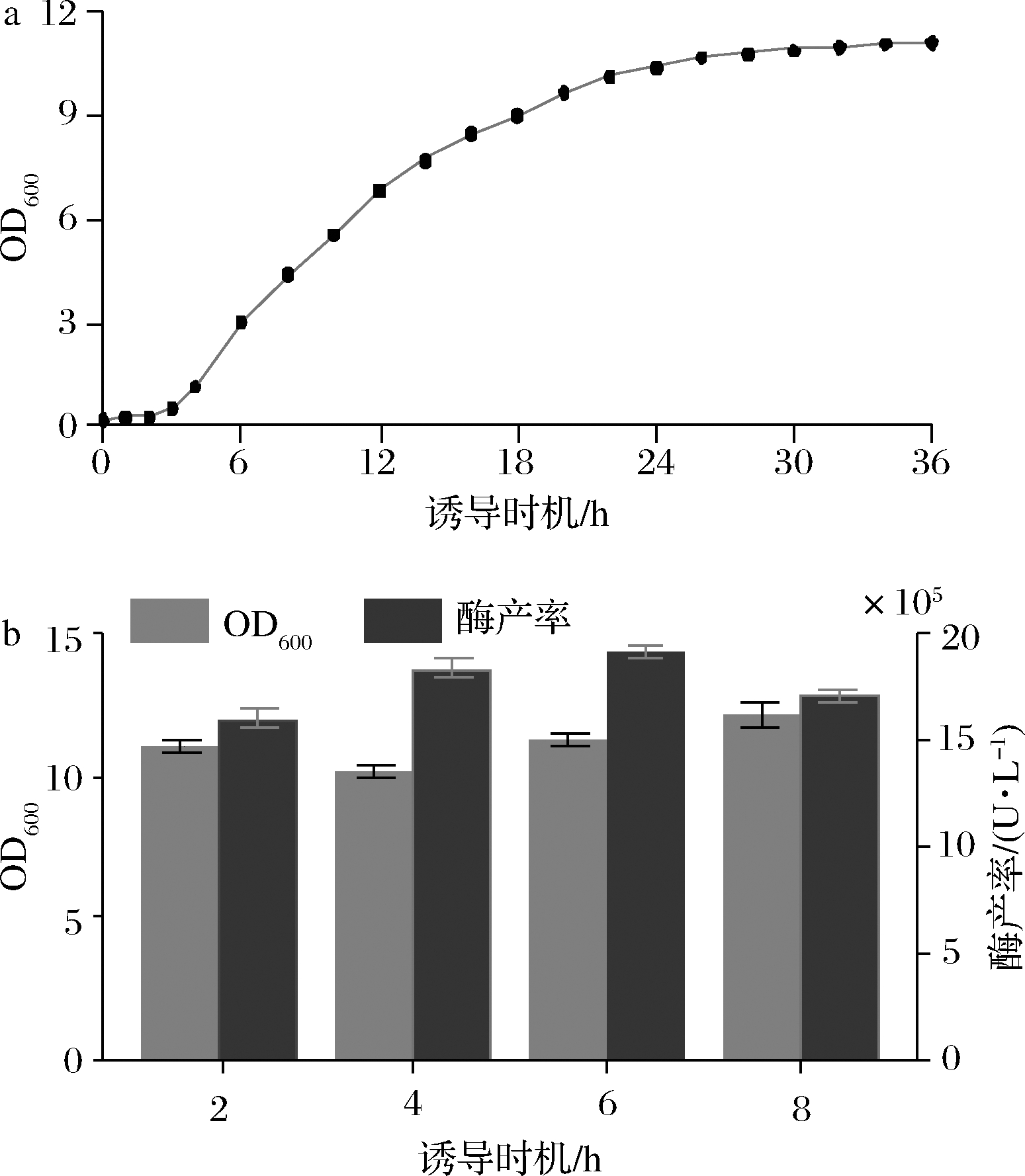
a-菌体浓度;b-酶产率
图6 诱导时机对菌体生长及酶产率的影响
Fig.6 Effect of induction times on the growth of engineering bacteria and Pst I production
2.2 Pst I 蛋白纯化与酶活力分析
使用优化的发酵方案:控制发酵体系pH 8.0,温度37 ℃,当发酵进行到6 h时,补加终浓度1.4 mmol/L IPTG进行诱导,诱导后发酵时长为8 h。发酵结束后离心收集菌体,破碎细胞后依次使用Ni亲和层析柱与肝素亲和层析柱进行纯化,并用SDS-PAGE分析。由图7可知蛋白条带清晰明显,条带对应分子量符合目的蛋白(40.7 kDa)。经NanoDrop Lite 分光光度计测定蛋白浓度,换算得到优化后的Pst I蛋白产率为0.0129 g/L,酶产率为1.926×106 U/L。
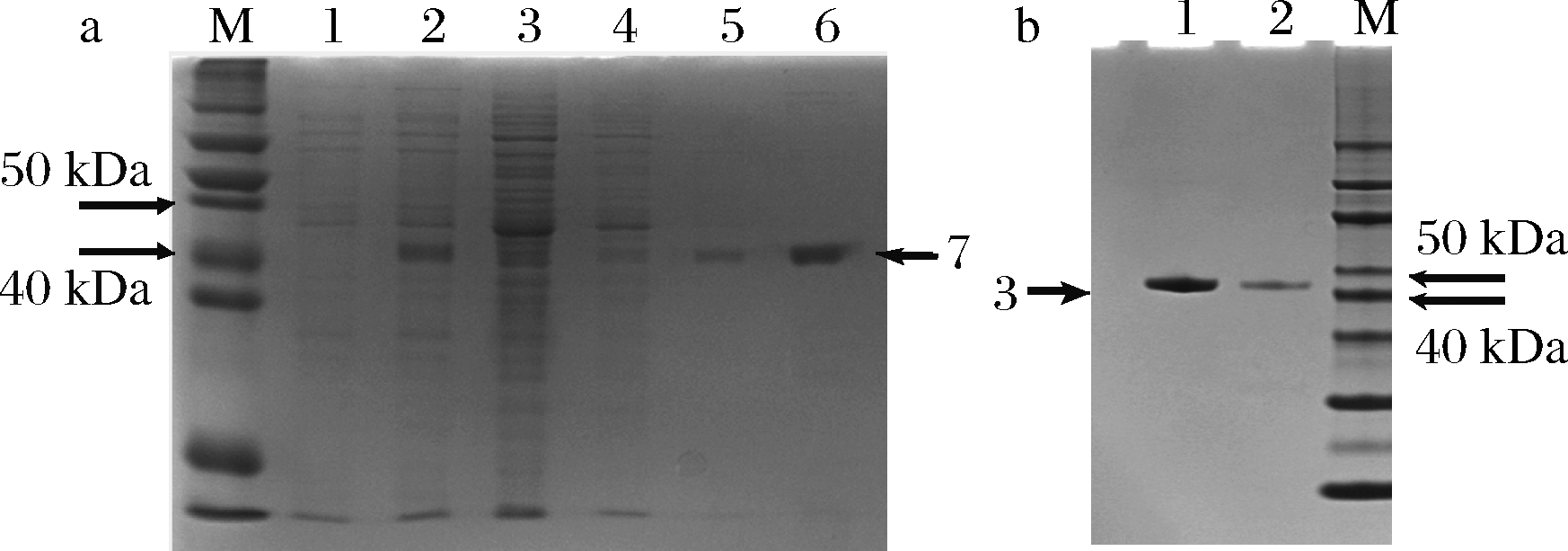
a-Pst I Ni柱纯化结果,M-marker,1-5分别为使用不同浓度咪唑的洗脱液,6-含有目的蛋白的洗脱液,7-标注的蛋白条带;b-Pst I 肝素柱纯化结果,M-marker,1和2为使用肝素纯化后的目的蛋白,3-标注的蛋白条带
图7 SDS-PAGE分析重组Pst I蛋白纯化结果
Fig.7 SDS-PAGE of purified recombinant Pst I protein
而相关企业使用优化前的条件,在发酵罐中所获得的蛋白产率仅为0.006 g/L,酶产率仅为5.14×105 U/L。可见发酵工艺经过优化后,Pst I的蛋白产率提高到2.15倍,酶产率提高到3.74倍(图8)。
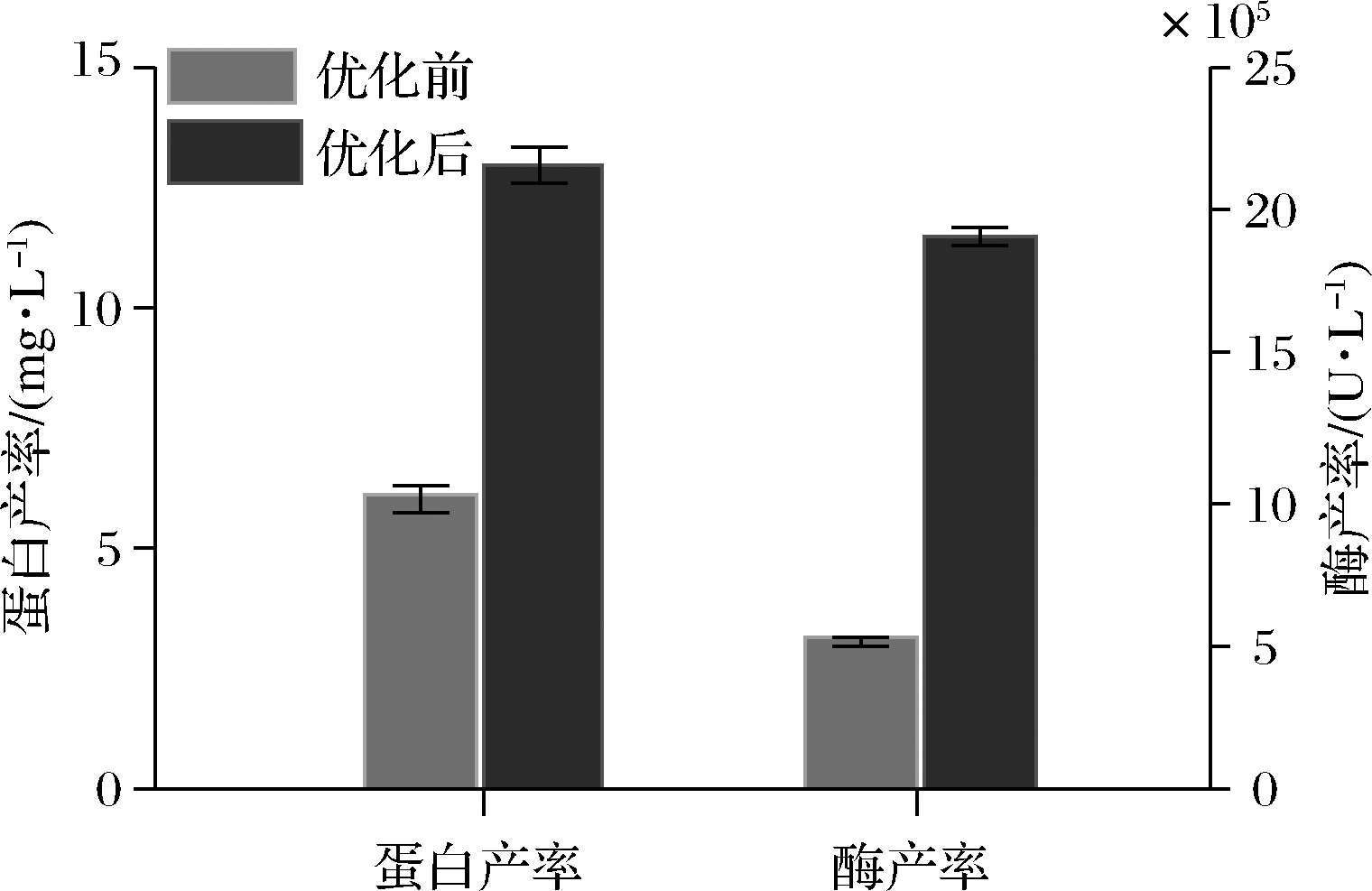
图8 优化前与优化后蛋白产率与酶产率比较
Fig.8 Protein yield and active enzyme yield before and after optimization
3 结论
本研究以实验室前期通过广谱甲基化保护,初步实现了部分限制性内切酶的国产化生产的前提下,以限制性内切酶Pst I为对象,进行了高密度发酵工艺的初步探索。通过单因素试验筛选了诱导温度、诱导时间、诱导剂浓度、补充碳源、pH值与诱导时机等多个发酵条件。结果表明,在37 ℃下,开始发酵后6 h,添加终浓度1.4 mmol/L IPTG进行诱导发酵8 h,以甘油为补充碳源,控制发酵体系pH为8.0。在此发酵条件下Pst I蛋白产量为0.0129 g/L,为未优化的2.15倍,同时酶产率为1.926×106 U/L,为未优化的3.74倍。后续还需要进一步优化条件,继续提升菌体浓度和酶产率,以实现高密度发酵。本研究建立的发酵工艺已被用于Pst I的商业化生产,并可以为其他限制性内切酶的大规模生产提供参考依据。

 010 - 86226008
010 - 86226008 483825188@qq.com
483825188@qq.com



